Tvrdosť vody a jej eliminácia. Úlohy a cvičenia pre kovy podskupiny iA
Strana 1
Odstránenie dočasnej tvrdosti sa uskutoční vriacou vodou. Po varení sa uhľovodíky ničia a zle rozpustné uhličitany sa tvoria zrazeniny. Keď sa do vody zavedie uhličitan sodný, hydroxid vápenatý, odstráni sa celková tvrdosť vody. V tomto prípade je uhličitanová tvrdosť odstránená vápnom a nemykarbonátová tvrdosť je odstránená pomocou sódy.
Vápno okrem eliminácie dočasnej tvrdosti zráža všetok horčík a železo z vody a podporuje koaguláciu organických a anorganických koloidov.
Po vyčistení nečistôt, odstránení dočasnej tvrdosti a odvzdušnenia, sa doplňujúca voda privádza do výmenníka tepla (2), kde sa ohrieva na 335 K. Po zmiešaní sa doplňujúca a vratná voda čerpá do druhej zóny výmenníka tepla (2), kde sa zahrieva na 355 K a tečie do vykurovacie siete.
Zmäkčenie sa často používa na odstránenie dočasnej tvrdosti vody, ktorá je určená na vyrovnanie strát (doplňovanie) v uzavretých systémoch zásobovania cirkulujúcou vodou a na zabránenie minerálneho znečistenia povrchov na výmenu tepla a chladenie pri kontakte s cirkulujúcou vodou. V mnohých prípadoch je doplnková voda hlavným zdrojom akumulácie iónov vápnika a biokarbonátov v cirkulujúcej vode, ktorá v systémoch s vysokými koeficientmi vyparovania môže narušiť stabilné zloženie cirkulujúcej vody.
Zmäkčenie vody, aby sa vylúčila dočasná tvrdosť, sa uskutočňuje chemicky zavádzaním činidiel, ktoré sa používajú ako vápno, kyselina sírová alebo kyselina chlorovodíková. Chemické metódy dosahujú relatívne plytké zmäkčenie vody. Pre vyšší stupeň zmäkčovania sa používajú metódy výmeny katiónov, ktorých podstatou je využitie schopnosti určitých látok vymieňať katióny sodíka v nich obsiahnutých za katióny solí tvrdosti vo vode.
Lúh sodný sa používa v tepelných elektrárňach na odstránenie dočasnej tvrdosti vody, na regeneráciu anovitických filtrov používaných v rastlinách na chemické odsoľovanie vody.
Lúh sodný sa používa v tepelných elektrárňach na odstránenie dočasnej tvrdosti vody a na regeneráciu aniónových filtrov používaných v zariadeniach na chemické odsoľovanie.
Podobne by sa malo počítať aj množstvo Ca (OH) 2 potrebné na odstránenie dočasnej tuhosti.
Prečo sa na odstránenie dočasnej tuhosti v dôsledku solí horčíka vyžaduje viac vápna ako na odstránenie dočasnej tuhosti v dôsledku solí vápnika.
Z tohto dôvodu by sa na doplnenie uzavretých (bez čistiacich) systémov prívodu vody malo vykonať relatívne hlboké zmäkčenie doplňovacej vody a odstránenie dočasnej tvrdosti.
Zavádzanie malých množstiev alkalických činidiel zvyšuje účinnosť magnetického spracovania vody, hoci zavádzanie alkalických činidiel, napríklad vápna v množstvách nepresahujúcich 10 - 20% množstiev potrebných na odstránenie dočasnej tuhosti, podľa štúdií vykonaných v KhIEI v roku 1959, znižuje tvorbu vodného kameňa. 8 až 10 krát.
V tomto prípade sa odstráni šesť kosťová voda spôsobená hydrogenuhličitanmi. Táto tuhosť sa preto nazýva dočasná alebo hydrogenuhličitanová. Preto na odstránenie dočasnej tuhosti stačí prevariť vodu.
Soli s konštantnou tvrdosťou, napríklad CaCl, CaSO4 atď., Sa pri zahrievaní neodstraňujú z vody. Zrážajú sa počas odparovania vody a vytvárajú sa na stenách prístroja, ktoré sa ťažko odstraňujú v hustej miere. Tvrdá voda sa môže použiť iba v prípadoch, keď podmienky jej použitia nespôsobujú zrážanie tuhých zrazenín, napríklad v chladničkách, kde sa chladiaca voda nezohrieva na teplotu, ktorá pomáha eliminovať dočasnú tvrdosť. V kotolniach, kde je voda nielen ohrievaná, ale tiež sa vyparuje, je neprijateľná nielen dočasná, ale aj konštantná tvrdosť. Preto je voda pre ne predbežne čistená zo solí vápnika a horčíka chemickou metódou v špeciálnych rastlinách.
Obecná vzdelávacia inštitúcia
„Číslo strednej školy 1
s hĺbkovým štúdiom jednotlivých predmetov
Adresa: Belgorodská oblasť,
Skúška tvrdosti vody
a spôsoby, ako ju odstrániť
študent 11 "A" trieda MOU "Priemer
stredná škola číslo 1
s hĺbkovou štúdiou
jednotlivé položky
Adresa: Belgorodská oblasť,
Vedecký poradca :,
učiteľ chémie
stredná škola číslo 1
s hĺbkovou štúdiou
jednotlivé položky
nový Oskol, región Belgorod
Adresa: Belgorodská oblasť,
nový Oskol,
nový Oskol
1. Úvod ……………………………………………………………………… .3
2. Tvrdosť vody a spôsoby jej odstránenia …………………………… .4
· Prečo je voda tvrdá .......................................................... 4
· Hodnota tvrdosti vody v ľudskom živote ...................................... 4
· Spôsoby odstránenia tuhosti ……………………………………… ... 5
3. Štúdium tvrdosti vody a metódy jej eliminácie .............. ... 8
4. Záver a závery
5. Zoznam odkazov
úvod
Ktorý študoval vedy, ale neuplatňuje ich,
podobné tomu, ktorý oral, ale nesieva.
Saadi
V 80. rokoch 20. storočia sa knihy Paula Chappiusa Bragga objavili o propagácii zdravého životného štýlu. Aj keď mnohí vedci považujú jeho názor za kontroverzný, knihy Paula Bragga si zaslúžia pozornosť. Jedna z častí jeho knihy (Moje prvé experimenty s tvrdosťou) je venovaná problému tvrdosti vody, kde autor vo svojich spomienkach popisuje chorobu svojho starého otca, ktorý zomrel v dôsledku toho, že jeho krvné cievy sa skameneli z tvrdej vody, a ženy, ktorá žila v ich častiach ( nešťastná žena sa volala kamenná žena, pretože jej telo bolo doslova skamenené veľkým množstvom solí). Táto žena bola jednou z mnohých obetí tvrdej vody. Nešťastné orgány sa nedokázali vyrovnať so spracovaním veľkého množstva anorganických látok obsiahnutých v takejto vode a začali sa veľmi aktívne hromadiť v tele.
Zlúčeniny vápnika sa v našom tele zrážajú vo forme obličkových kameňov a žlčníka.
Úprava vody dnes nie je rozmarom a hýčkaním, ale skôr nevyhnutnou nevyhnutnosťou. Faktom je, že také nepríjemné javy ako spodina, facky tretích strán, pachy a prítomnosť zakalenej zrazeniny nespôsobujú len veľa nepríjemností, ale spôsobujú aj mnohé choroby. Voda nízkej kvality podporuje ukladanie solí, urýchľuje proces starnutia tela a stáva sa príčinou prechodu mnohých chorôb do chronického štádia. Okrem toho chlór obsahuje množstvo látok, ktoré môžu spôsobiť rakovinu. Voda je však základom všetkého života a ani jeden živý organizmus sa neobíde bez vody. Napríklad, osoba sa skladá z vody na 60-65%. Čistá voda je preto nevyhnutná pre každého človeka. Bohužiaľ, prírodná voda v našej dobe je úplne nevhodná na konzumáciu bez predbežnej úpravy, čo potvrdzujú rôzne analýzy vody. Každý vie, že filtračné stanice, ktoré údajne vykonávajú čistenie vody, už dlho potrebujú veľké opravy a systémy zásobovania vodou, ktorými sa voda dodáva do našich domovov, si vyžadujú výmenu.
Cieľom našej práce bolo študovať úroveň tvrdosti vody v našom rodnom meste.
Tvrdosť vody a spôsoby jej eliminácie
Prečo voda stvrdne
Vápnik a jeho zlúčeniny sú pre organizmus veľmi potrebné: koniec koncov, z orthofosforečnanu vápenatého Ca3 (P04) 2 sú zložené kosti a zuby ľudí a zvierat. Sú tvorené z rozpustných zlúčenín vápnika, ktoré prenášajú krv v tele. Vďaka vápnikovým katiónom Ca2 + je krv schopná zrážať, tvoriť zrazeniny, upchávať rany a zastavovať krvácanie.
Zlúčeniny vápnika sú nielen užitočné, ale tiež veľmi škodlivé - napríklad, keď tvrdej vode dodávajú tvrdosť. V každodennom živote sa slovo „tuhosť“ na prvý pohľad môže vzťahovať iba na tuhé látky: parková lavica alebo stolička v kuchyni môžu byť pevné. Voda je však tiež tvrdá.
Hlavným zdrojom solí horčíka a vápnika vstupujúcich do vody sú ložiská vápenca, sadry a dolomitov, ktoré sú erodované prírodnými vodami.
Vo vodách s nízkym obsahom solí je väčšina vápnikových iónov. So zvýšením stupňa mineralizácie obsah vápnikových iónov rýchlo klesá a zriedka prekračuje 1 g / l. Obsah iónov horčíka v mineralizovaných vodách môže dosiahnuť niekoľko gramov a v slaných vodách niekoľko desiatok gramov.
Tvrdosť vody - kombinácia chemických a fyzikálnych vlastností vody spojená s obsahom rozpustených solí kovov alkalických zemín, najmä vápnika a horčíka. Voda s vysokým obsahom takýchto solí sa nazýva tvrdá voda s nízkym obsahom - mäkká. Existujú dočasné tuhosti (uhličitany) tvorené uhľovodíkmi a trvalé tuhosti (neuhličitany) spôsobené prítomnosťou iných solí. Dočasná tuhosť je spôsobená prítomnosťou hydrogenuhličitanov vápenatých a horečnatých (Ca (HCO3) 2; Mg (HCO3) 2) vo vode. Konštantná tvrdosť vody je spôsobená prítomnosťou síranov, Ca a chloridov horečnatých vo vode (CaSO4, CaCl2, MgS04, MgCl2) vo vode.
Hodnota tvrdosti vody v ľudskom živote
Tvrdosť vody je súčet vápenatých iónov Ca2 + a Mg2 + rozpustených vo vode.
Vápnikové a horečnaté ióny nepoškodzujú živé organizmy, ale ich prítomnosť vo vode vo veľkých množstvách je nežiaduca, pretože takáto voda nie je vhodná pre potreby domácnosti.
V tvrdej vode sa spotreba mydla a prášku zvyšuje pri praní odevov, mäsa a zeleniny a pomaly sa trávi a znižuje sa pohyblivosť žalúdka. Tvrdá voda nie je vhodná pre systémy zásobovania vodou a zariadenia na ohrev vody.
Tvrdosť sa meria v miligramoch ekvivalentov na liter (mEq / l). Priemyselné normy pre prípustné hodnoty tuhosti závisia od typu použitého zariadenia. Spravidla sa berie do úvahy tvrdá voda s tvrdosťou 1 mEq / L alebo viac.
Tvrdosť je najbežnejším problémom kvality vody. Pôvodne sa výraz „tvrdá voda“ používal na vodu, ktorá sa ťažko umývala.
Tvrdá voda po umytí zaschne pokožku a pri použití mydla sa v nej zle vytvára pena. Použitie tvrdej vody spôsobuje, že sa na stenách kotlov, v potrubiach atď. Vytvára sediment (vodný kameň). Použitie príliš mäkkej vody môže viesť k korózii potrubí, pretože v tomto prípade nie je prítomný žiadny kyslý roztok na vyrovnávanie obsahu uhľovodíkov. (dočasná) tuhosť. Konzumácia tvrdej alebo mäkkej vody zvyčajne nie je zdraviu škodlivá, hoci existujú dôkazy, že vysoká tuhosť prispieva k tvorbe močových kameňov a nízka - mierne zvyšuje riziko kardiovaskulárnych chorôb.
Tvrdosť prírodných vôd sa môže značne líšiť a je nestabilná po celý rok. Tvrdosť sa zvyšuje v dôsledku vyparovania vody, klesá počas obdobia dažďov, ako aj počas topenia snehu a ľadu.
Spôsoby odstránenia tuhosti
rozlíšiť celkovo tuhosť, ktorá sa skladá z dočasný a stály.
Varu.
dočasný tuhosť (na jedno použitie alebo uhličitan) je spôsobená prítomnosťou hydrogenuhličitanov Ca (HCO3) 2 a Mg (HCO3) 2 vo vode. Tvrdosť uhlíka sa dá ľahko odstrániť vriaca vodav ktorých sa Ca2 + a Mg2 + odstránia za vzniku nerozpustných zrazenín:
Ca (HCO3) 2 CaCO3 ↓ + CO2 + H20
Ióny horčíka sa zrážajú vo forme zásaditého uhličitanu alebo vo forme hydroxidu horečnatého (pri pH\u003e 10,3).
2Mg2 + + OH) 2CO3 ↓ + CO2 + H20
(OH-ióny sa tvoria v dôsledku interakcie iónov s vodou: a rovnováha sa pri zahrievaní posúva doprava).
Na zníženie tvrdosti uhličitanu metóda vápnenia do ktorého sa privádza upravená voda vápnoCa (OH) 2. Reakcie, ktoré sa vyskytujú so zavedením vápna, sa môžu písať v molekulárnej forme:
Ca (HCO3) 2 + Ca (OH) 2 → 2CaC03 ↓ + H20
Mg (НСО3) 2 + Са (ОН) 2 → Mg (ОН) 2 ↓ + 2СаСО3 + Н2О
Nepretržitá tvrdosť (neodstrániteľná alebo neuhličitanová) sa udržuje pri prevarení vody, pretože konštantná tvrdosť je spôsobená prítomnosťou síranov, chloridov a iných solí Ca a Mg vo vode. Kvantitatívne sa rovná koncentrácii iónov Ca2 + a Mg2 + mínus časová tvrdosť. Zvyčajne sa používa na zníženie tvrdosti uhličitanu. sóda jedlá sóda (Na2CO3):
MgS04 + Na2C03 → MgC03 ↓ + Na2S04
Počas pridávania výfuk a sóda môžete sa zbaviť tvrdosti uhličitanu a uhličitanu ( metóda vápna-sóda).
Celá tuhosť sa eliminuje aj pri podávanie fosforečnan sodný, tetraboritan sodný pretože ortofosfáty sú menej rozpustné ako uhličitany, je ich použitie pri zmäkčovaní vody vhodnejšie:
3CaSO4 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 3Na2SO4
Základom je moderný spôsob zmäkčovania vody použitie iónomeničové živice - iónomeniče (katiónové meniče a aniónomeniče). Katiónové výmenníky sú syntetické ionomeničové živice - hlinitokremičitany, napríklad:
Ich zloženie môže byť podmienečne vyjadrené všeobecným vzorcom Na2R, kde Na + je vysoko mobilný katión a R - je častice katiónomeniča, ktorá nesie záporný náboj.
Keď tvrdá voda preteká vrstvou katexovej živice, vymieňajú sa katióny podľa reakcií:
Ca2 + + Na2R → 2Na + + CaR
Mg2 + + + Na2R -\u003e 2Na + + MgR
Preto ióny Ca2 + a Mg2 + prechádzajú z roztoku na katexovú živicu. Na obnovenie katexovej živice sa premyje koncentrovaným roztokom NaCl:
CaR + 2NaCl → CaCl2 + Na2R
Po premytí je možné katiónovýmennú živicu znovu použiť na odstránenie tuhosti z vody.
Reverzná osmóza, Metóda je založená na priechode vody cez semipermeabilné membrány (obvykle polyamid). Spolu so soľami tvrdosti sa odstráni aj väčšina ďalších solí. Účinnosť čistenia môže dosiahnuť 99,9%. Táto metóda našla najväčšie uplatnenie v domácich systémoch úpravy pitnej vody. Ako nevýhoda tohto spôsobu je potrebné uviesť potrebu predbežnej prípravy vody privádzanej na membránu reverznej osmózy.
Elektrodialýzou. Je založená na odstraňovaní solí z vody pôsobením elektrického poľa. Odstránenie iónov rozpustených látok nastáva v dôsledku špeciálnych membrán. Rovnako ako pri technológii reverznej osmózy sa okrem tvrdých iónov odstraňujú ďalšie soli.
Tepelná metóda, Na základe ohrevu vody eliminuje iba dočasnú (uhličitanovú) tuhosť. Nájde uplatnenie v každodennom živote. V priemysle sa používa napríklad v tepelných elektrárňach.
Zmäkčenie činidla. Metóda je založená na pridaní sódy alebo haseného vápna do vody. V tomto prípade vápenaté a horečnaté soli prechádzajú do nerozpustných zlúčenín a ako výsledok sa zrážajú. Táto metóda je opodstatnená pri pomerne vysokej spotrebe vody, pretože je spojená s riešením množstva špecifických problémov: filtračný kal, presné dávkovanie činidla.
katexový. Metóda je založená na použití granulovanej náplne iónomeniča (najčastejšie iónomeničové živice). Tento kontakt pri kontakte s vodou absorbuje katióny solí tvrdosti (vápnik a horčík). Výmenou v závislosti od iónovej formy rozdávanie sodíkových alebo vodíkových iónov. Tieto metódy sa nazývajú Na-katión a H-katión. Tvrdosť vody spravidla klesá pri jednostupňovej katióne sodíka na 0,05 až 0,1 mekv / l, pri dvojstupňovej k 0,01 mekv / l.
Najlepšie činidlo Na odstránenie všeobecnej tvrdosti vody je oofosfát sodný Na3PO4: 3Ca (HCO3) 2 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 6NaHCO3 3MgSO4 + 2Na3PO4 → Mg3 (PO4) 2 ↓ + 3Na2SO4 Vo vode slabo rozpustný ortofosforečnan vápenatý lepšie zmäkčovanie vody. V priemysle sa pomocou iónomeničových filtrov nahradia vápnikové a horčíkové ióny sodnými a draselnými iónmi, čím sa vytvorí mäkká voda. U domácich filtrov na pitnú vodu dochádza k určitému zmäkčeniu vody. Filtrovaná voda poskytuje menšie množstvo vodného kameňa. Voda sa môže úplne čistiť destiláciou (destiláciou).
Dnes sú vynikajúce vodné filtre ktoré sa inštalujú v byte bez problémov a slúžia ako vynikajúci nástroj na kvalitnú úpravu vody. Možno mnohí dnes uprednostňujú nákup balenej čistej vody v supermarketoch. Výber takejto vody je skutočne obrovský, ale je možné si byť stopercentne istý jej kvalitou? Možno nie! Preto je čistenie vody pomocou špeciálne navrhnutých filtrov na čistenie najoptimálnejším riešením pre moderného človeka, ktorý sa stará o svoje zdravie a zdravie svojich blízkych. Systémy na čistenie vody sú veľmi rozmanité. Spravidla sa líšia: výkon, niektoré parametre, stupeň čistenia vody, ako aj dizajn. Vodné filtre dokonale čistú vodu a sú vhodné na pitie, znižujú obsah hliníka, železa, mangánu, chlóru, všetkých druhov dusičnanov v nej. Okrem toho filtre na čistenie vody pomáhajú eliminovať nepríjemný zápach, chuť a zbaviť sa baktérií a baktérií obsiahnutých vo vode. Voda, ktorá bola vyčistená takýmito systémami, sa stáva menej tuhou, nestráca však užitočné látky potrebné pre ľudské telo. Vodné filtre sú vynikajúcou príležitosťou na príjem vyčistenej vody v neobmedzenom množstve bez toho, aby ste opustili svoj domov. Správne vybraný filter bude vynikajúcim riešením problému s čistou vodou, zlepšuje zdravie a predlžuje životnosť.
Štúdium tvrdosti vody a metódy jej eliminácie
Tvrdosť vody je spôsobená prítomnosťou iónov Ca2 + a Mg2 +. Čím vyšší je ich obsah v prírodnej vode (voda prechádzajúca vápenatými horninami a pôdami), tým väčšia je jej tvrdosť.
Kvantitatívne je tvrdosť vody vyjadrená ako súčet miliekvivalentov iónov Ca2 + a Mg2 + obsiahnutých v jednom litri vody (meq / l). Jeden miliekvivalent tvrdosti zodpovedá obsahu 20,04 mg / l Ca2 + iónov alebo 12,16 mg / l Mg2 + iónov.
Preto pri riešení problémov môžete použiť vzorec:
(mmol - ekviv / l),
kde m - hmotnosť látky, ktorá robí tvrdosť vody alebo sa používa na odstránenie tvrdosti vody, mg;
mae- ekvivalentná hmotnosť tejto látky, g / mol;
V- objem vody, l
Tvrdosťou sa všetky prírodné vody delia na mäkký(celková tvrdosť menej ako 2 mmol / l) a húževnatýs priemerným stupňom tuhosti (2 až 10 mmol / l) a vysokým stupňom tuhosti (viac ako 10 mmol / l).
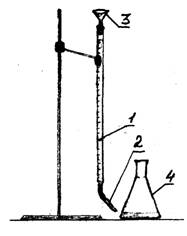
1 - byreta
2 - kvapkadlo
3 - lievik
Obrázok 1 - Experimentálne nastavenie
Výkonnostné skúsenosti
V troch bankách odmerajte pomocou veľkého odmerného valca 100 ml vody. Do každej banky s vodou pridajte 2-3 kvapky indikátora metylooranžovej farby. Titrácia sa uskutočňuje 0,1 N. roztok kyseliny chlorovodíkovej pomocou byrety. Nastavte hladinu kyseliny v byrete na nulové delenie. Nalievajte po kvapkách kyselinu chlorovodíkovú, až kým sa farba roztoku nezmení zo žltej na oranžovo-ružovú. Zaznamenajte množstvo kyseliny, ktoré prešlo do titrácie. Opakujte titráciu ešte dvakrát. Zadajte údaje do tabuľky.
Výpočet sa vykonáva podľa vzorca:
![]() (mmol - ekviv / l),
(mmol - ekviv / l),
kde je normálna koncentrácia kyseliny chlorovodíkovej;
Vcp ( HCl) - priemerný objem HCl, preč na titráciu;
Voda - objem vody odobratej na titráciu.
Získané údaje sme navrhli vo forme tabuľky.
Vzorka vody
používa sa na titráciu
používa sa na titráciu filtrovanej vody
Skrinka na pitnú vodu - chémia
Voda z vodovodu. letectvo
Voda z vodovodu. október
Voda zo stĺpca - p. Pobrežná
Voda z vodovodu. Pokrovský
Voda zo studne. Pokrovský
Voda z vodovodu. Belgorod
Voda z vodovodu. vojak
Sodná voda „Krásna“
V podmienkach školského laboratória sme uskutočnili štúdium vody odobratej z rôznych zdrojov na tvrdosť. Na stanovenie tvrdosti sa použila titrácia prírodnej vody kyselinou chlorovodíkovou v prítomnosti indikátora metylooranžovej farby. Uhličitanová tvrdosť vzorky vody sa stanovila pred a po priechode cez filter pre domácnosť (použil sa Aquafor).
Výsledkom práce boli nasledujúce závery:
1) Voda v meste Nový Oskol je tvrdá (W \u003d 7-10,5). Mnoho ľudí žije v súkromnom sektore a používa vodu zo studní, a táto voda je veľmi tvrdá.
2) Voda vstupujúca do vody je podrobená čisteniu a zmäkčovaniu (L \u003d 6-7), preto ju možno považovať za strednú tvrdosť (podľa GOST by celková tvrdosť pitnej vody nemala byť vyššia ako 7 mmol / l).
3) Najjednoduchší domáci spôsob zmäkčovania vody je tradične varenie.
4) Pokusy ukázali, že domáce filtre tiež dokonale zmäkčujú vodu. Takže voda odobratá na výskum zo studne na ul. Pokrovský (tvrdosť 10,5 mmol / l) mal po filtrácii tvrdosť iba 2 mmol / l, čo je dokonca nižšia ako fyziologická norma (3,5 mmol / l). Preto sú vodné filtre vynikajúcou príležitosťou na príjem vyčistenej vody v neobmedzenom množstve bez toho, aby ste opustili svoj domov.
Zoznam odkazov
1.,. sprievodca praktickými hygienickými cvičeniami s technikou sanitárneho výskumu. - M .: „Medicína“, 19. roky.
2. a. Základy chemickej analýzy. Študijný sprievodca pre študentov. - M.: "osvietenie", 1971. - 192 s.
3. Anorganická chémia: Učebnica. pre technológa špec. univerzít. - M.: Vyššia. school., 1989. - 432 s.
4,. Monitorujeme životné prostredie nášho mesta: ročníky 9-11: Školský workshop. - M.: Humanita. ed. VLADOS Center, 2001. - 112 s.
5. Chémia: Ref. vyd. / B. Schroeter, K.-H. Lautenschleger, H. Bibrak a kol .: Per. s tým. M .: Chemistry, 1989. - Per. vyd.: GDR, 1986. - 648 s.
Transformačné reťazce
1. Uhličitan vápenatý Oxid vápenatý Hydroxid vápenatý Uhličitan vápenatý Dusičnan vápenatý.
2. Síran horečnatý, dusičnan horečnatý, oxid horečnatý, octan horečnatý.
3. Chlorid vápenatý Síran vápenatý Síran vápenatý Síran vápenatý Hydroxid vápenatý Oxid vápenatý Hydrogenuhličitan vápenatý.
4. Oxid horečnatý Magnézium Hydroxid horečnatý Chlorid horečnatý Hydroxykarbonát horečnatý Síran horečnatý Hydroxid horečnatý.
5. Síran horečnatý oxid horečnatý ... hydroxid horečnatý ... dusičnan horečnatý.
6. Hydroxid vápenatý Vápnik Uhličitan vápenatý Oxid vápenatý Karbid vápenatý Hydroxid vápenatý Hydrogenuhličitan vápenatý.
Úlohy vyrovnania
Úroveň A
1. Interakcia 13,7 g kovu s vodou uvoľní 2,24 litra plynu (n.a.). Identifikujte kov. Aká zrazenina a v akom množstve sa vytvorí, ak sa k výslednému roztoku pridá prebytok síranu sodného?
rozhodnutie
Plyn (H2) sa uvoľňuje počas interakcie podskupín Mla a IIa s vodou.
Podľa zákona o ekvivalentoch:
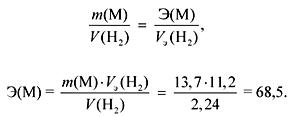
Ak sú podskupiny Mla, potom
r (M) \u003d E valencia \u003d 68,5 (žiadny taký kov).
Ak sú podskupiny M IIa, potom
r (M) \u003d E valencia \u003d 137 (Ba).
Ba + 2H20 \u003d Ba (OH) 2 + H2,
Ba (OH) 2 + Na2S04 \u003d BaSO4 + 2NaOH,
(BaS04) \u003d (Ba (OH) 2) \u003d (Ba) \u003d\u003d 0,1 mol,
m(BaS04) \u003d M\u003d 0,133 \u003d 23,3 g.
Odpoveď, Kov - Ba; m(BaS04) \u003d 23,3 g.
2. Aký objem 0,5 M roztoku hydroxidu vápenatého by sa mal pridať k 81 g 10% roztoku (hustota 1 g / cm3) hydrogenuhličitanu vápenatého na dokončenie tvorby sedimentu? Stanovte hmotnosť sedimentu.
Odpoveď, 100 ml Ca (OH) 2, 10 g CaC03.
3. Roztok obsahujúci 23,3 g zmesi síranu draselného a chromátu bol ovplyvnený nadbytkom chloridu bárnatého. Zrazenina sa odfiltruje, premyje sa a potom sa k nej pridá prebytok kyseliny chlorovodíkovej. Časť zrazeniny sa rozpustila, zostávajúca časť sa prefiltrovala, premyla a vysušila. Hmotnosť zrazeniny po vysušení bola 23,3 g. Stanovte zloženie pôvodnej zmesi.
Odpoveď, 17,4 g K2S04 a 5,9 g K2Cr04.
4. Existuje zmes vápnika, oxidu vápenatého a karbidu vápenatého s molárnym pomerom zložiek 1: 3: 4 (v poradí podľa zoznamu). Aký objem vody môže vstúpiť do chemickej interakcie s 35 g takejto zmesi?
Odpoveď, 17,568 ml.
5. Rozpustnosť hydroxidu strontnatého vo vode pri 100 ° C je 28 g a pri 25 ° C - 1 g na 100 g vody. 200 g roztoku hydroxidu strontnatého nasýteného pri 100 ° C sa ochladilo na 25 ° C. Po ochladení roztoku sa vyzráža hmota oktahydrátu hydroxidu strontnatého.
Odpoveď, 93,08 g Sr (OH) 28H20.
Úroveň B
1. Určitá hmotnosť kryštalického uhličitanu horečnatého sa kalcinovala, až kým neprestal vývoj plynu. Posledne uvedené sa nechali prejsť preplachovacími fľašami koncentrovanou kyselinou sírovou a vápennou vodou. Hmotnosť prvej banky sa zvýšila o 1,8 g av druhej 2 g zrazeniny klesla. Stanovte zloženie východiskového kryštalického hydrátu a jeho hmotnosť.
Odpoveď, Pentahydrát MgC03 5H20; 3,48 g
2. Molárny pomer uhličitanu, hydrogenuhličitanu a dusičnanu vápenatého v zmesi s hmotnosťou 100 g je 1: 2: 3 (v poradí podľa zoznamu). Aký objem pri 1200 ° C a normálnom tlaku spotrebujú plynné produkty rozkladu tejto zmesi?
rozhodnutie
Rovnice rozkladných reakcií zložiek zmesi:
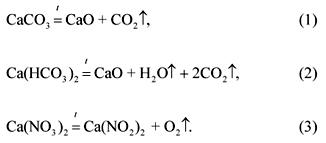
Podľa stavu problému:
(CaC03): (Ca (HCO3) 2): (Ca (N03) 2) \u003d 1: 2: 3.
Nech (CaCO3) \u003d x krtek.
Potom (Ca (HCO3) 2) \u003d 2 x;
(Ca (N03) 2) \u003d 3 x;
100x + 162 2x +164 3x \u003d100,
x 0,109 mol.
na r \u003d 101,3 kPa a t \u003d 1200 ° C v plynnom stave sa uvoľňuje:
CO2 podľa rovnice (1):
1 (C02) \u003d (CaC03) \u003d x \u003d 0,109 mol;
H20, CO2 podľa rovnice (2):
2 (H20) \u003d (Ca (HCO3) 2) \u003d 2 x \u003d 0,218 mol,
2 (C02) \u003d 2 (Ca (HCO3) 2) \u003d 4 x \u003d 0,436 mol;
O 2 podľa rovnice (3):
3 (02) \u003d (Ca (N03) 2) \u003d 3 x \u003d 0,327 mol.
Celkový počet mólov plynných produktov rozkladu:
0,109 + 0,218 + 0,436 + 0,327 \u003d 1,09 mol (n.a.).
Z rovnice stavu ideálnych plynov nájdeme objem:
pV = RT,
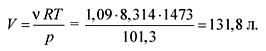
Odpoveď. V \u003d 131,8 litra
3. Bola kalcinovaná zmes rovnakých množstiev hydroxidu dvojmocného kovu a uhličitanu. Ukázalo sa, že hmotnosť pevného zvyšku bola 1,775 krát menšia ako hmotnosť pôvodnej zmesi. K tomuto zvyšku sa pridalo 10-krát väčšie množstvo 5% roztoku kyseliny sírovej. Vypočítajte hmotnostný podiel látok vo výslednom roztoku.
Odpoveď, 6% MgS04.
4. Keď sa voda spracovala zmesou hydridu a nitridu dvojmocného kovu s rovnakými hmotnostnými frakciami, vytvorila sa plynná zmes s hustotou vodíka 2,658. Nastavte kov obsiahnutý v zlúčeninách (pri výpočte nezaokrúhľujte čísla!).
Odpoveď, Vápnik.
5. Do 16% roztoku síranu meďnatého s hmotnosťou 350 g sa prikvapkalo 16 g horčíkovej doštičky. Po odstránení doštičky sa ukázalo, že hmotnostné frakcie solí obsiahnutých v roztoku boli rovnaké. Koľkokrát sa zvýšila hmotnosť taniera?
Odpoveď. 4,5 krát.
Úlohy kvality
1. Ktorá z týchto látok bude interagovať s hydroxidom horečnatým: kyselina chlorovodíková, kyselina dusičná, oxid uhličitý, chlorid sodný, hydroxid bárnatý, kyselina sírová, oxid meďnatý?
Odpoveď, HCI, HN03, H2S04.
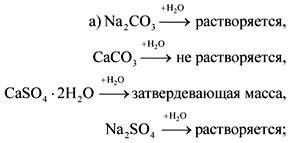
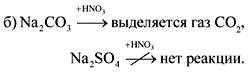
2. Vo fľašiach bez štítkov sú sóda, krieda, sadra a síran sodný. Ako je možné tieto látky rozoznať pomocou vody a kyseliny dusičnej?
Odpoveď.
3. Látka A je ľahký, pomerne tvrdý strieborno-biely kov. Pri interakcii látky A s B, ktorá je jednoduchou plynnou látkou, sa vytvorí zlúčenina C, ktorá je rozpustná vo vode za vzniku alkalického roztoku. Pri spracovaní látky s kyselinou sírovou sa tvorí soľ, ktorej kryštalický hydrát sa v medicíne používa na aplikáciu fixačných obväzov na zlomeniny. Uveďte reakčné rovnice.
Odpoveď, A je Ca; B je H2; C je CaH2; kryštalický hydrát - CaS04H20.
4. Látka A je oxid rozpustný vo vode za vzniku alkalického roztoku. Zlúčenina B v tomto roztoku reaguje s plynom C bez zápachu a vytvára bielu zrazeninu, ktorá sa postupne rozpúšťa, keď plyn ďalej prechádza C. Dajte reakčné rovnice a identifikujte látky.
Odpoveď, A je CaO, BaO; B je Ca (OH) 2, Ba (OH) 2; C je C02.
5. Látka A, ktorá je súčasťou jedného z najbežnejších minerálov v zemskej kôre, sa pri vysokej teplote rozkladá na dva oxidy, z ktorých jeden je vždy tvorený v procese života. Keď látka B interaguje s grafitom, zahrieva sa plyn C, ktorý je toxický pre teplokrvné zvieratá, horľavý, bezfarebný a bez zápachu. Uveďte rovnice reakcií, identifikujte látky.
Odpoveď, A - CaC03; B je C02; C - CO.
Tvrdosť vody a jej eliminácia
Abstrakt chémie
téma:„Tvrdosť vody“
Dodávateľ diela:Grabin Pavel.
plán
Úvod 3
Stanovenie tvrdosti vody. 3
Spevňovacie techniky 4
Referencie 6
úvod
V jaskyniach sa jaskyne stretávajú s najkrajšími vápencovými útvarmi - stalaktity visiace z oblúkov a stalagmity rastúce nahor. Z hľadiska chémie je vznikom týchto úžasných výtvorov prírody nepružnosť podzemnej vody. Koncept tvrdosti vody sa stretávame nielen v speleológii a geológii, ale všeobecne všade - v chémii, technike a dokonca aj v každodennom živote. Preto je tento koncept veľmi dôležitý pre stanovenie kvality vody.
Stanovenie tvrdosti vody
Tvrdosť vody - vlastnosť vody (ktorá sa nemá umývať, aby sa vytvorila váha v parných kotloch) spojená s obsahom vápnikových a horčíkových zlúčenín rozpustných v nej, je to parameter ukazujúci obsah vápenatých a horečnatých katiónov vo vode.
Tvrdosť sú špeciálne vlastnosti vody, ktoré do značnej miery určujú jej spotrebiteľské vlastnosti, a preto majú dôležitú ekonomickú hodnotu. Tvrdá voda vytvára vodný kameň na stenách vykurovacích kotlov, batérií atď., Čo výrazne zhoršuje ich tepelný výkon. Takáto tenká vrstva na vyhrievacom povrchu nie je vôbec neškodná, pretože doba zahrievania cez vrstvu vodného kameňa, ktorá má nízku tepelnú vodivosť, sa postupne zvyšuje, dno horí rýchlejšie a rýchlejšie - koniec koncov, kov ochladzuje pomalšie a pomalšie zakaždým, zostáva dlho v zahriatom stave. Nakoniec sa môže stať, že dno plavidla nevydrží a neumožní únik. Táto skutočnosť je veľmi nebezpečná v priemysle, v ktorom existujú parné kotly.
Tvrdá voda nie je vhodná na umývanie. Šupiny na ohrievačoch práčok ich vyradzujú z prevádzky, zhoršujú aj mycie vlastnosti mydla. Katióny Ca2 + a Mg2 + reagujú s mastnými kyselinami s mydlom za vzniku slabo rozpustných solí, ktoré vytvárajú filmy a zrazeniny, čo nakoniec znižuje kvalitu prania a zvyšuje spotrebu detergentu, t.j. tvrdá voda zle pení
Existujú dva typy tuhosti: dočasná a trvalá. Tento rozdiel je spôsobený typom aniónov, ktoré sú prítomné v roztoku ako protiváha vápnika a horčíka.
Dočasná tvrdosť spojený s prítomnosťou vo vode spolu s katiónmi Ca 2+, Mg 2+ a Fe 2+ hydrouhličitanu alebo hydrogenuhličitanových aniónov (HCO 3 -).
Trvalá tuhosť (alebo uhličitan) vzniká, ak sú v roztoku prítomné sírany, chloridy, dusičnany a iné anióny, ktorých vápenaté a horečnaté soli sú dobre rozpustné, a preto ich nemožno jednoducho odstrániť. Celková tvrdosť je definovaná ako celkový obsah všetkých solí vápnika a horčíka v roztoku.
Rôzne krajiny majú svoje vlastné normy tvrdosti vody. V našej krajine je voda klasifikovaná podľa tvrdosti týmto spôsobom:
Mäkká voda s tvrdosťou menšou ako 3,0 mEq / l,
Stredná tvrdosť 3,0 - 6,0 mEq / l
Tvrdé - viac ako 6,0 mEq / ml.
Metódy na odstránenie tuhosti.
Aby ste sa zbavili dočasnej tvrdosti, stačí iba prevariť vodu. Pri vriacej vode reagujú hydrogenuhličitanové anióny s katiónmi a tvoria s nimi veľmi zle rozpustné uhličitanové soli, ktoré sa vyzrážajú.
Ca2 + 2HCO3 - \u003d CaC03 ↓ + H20 + C02
U iónov železa je reakcia komplikovanejšia vzhľadom na skutočnosť, že FeCO3 je nestála látka vo vode. V prítomnosti kyslíka je konečným produktom reakčného reťazca Fe (OH) 3, čo je tmavočervená zrazenina. Preto čím viac železa vo vode, tým silnejšia je farba na stupnici, ktorá sa počas varu nanáša na steny a dno nádoby.
Neustále sa bojí o stálu tuhosť. Jedna možnosť: mrazivý ľad. Potrebujete len postupne zamrznúť vodu. Ak zostane približne 10% kvapaliny z pôvodného množstva, je potrebné vypustiť nezmrznutú vodu a ľad vrátiť späť do vody. Všetky soli, ktoré tvoria tvrdosť, zostávajú v nezmrazenej vode.
Jedlo je jedna cesta - destilácia, to znamená odparovanie vody s následnou kondenzáciou. Pretože soli sú neprchavé zlúčeniny, zostávajú a voda sa odparuje.
Metódy ako zmrazenie a destilácia sú však vhodné iba na zmäkčenie malého množstva vody. Priemysel sa zaoberá tonami. Preto sa používajú iné metódy. Najčastejšie používanou metódou výmeny katiónov založenou na použití špeciálnych činidiel - katiónomeničoch, ktoré sa plnia do filtrov a keď nimi prechádza voda, sa katióny vápnika a horčíka nahradia katiónom sodíka.
V dôsledku tvrdosti vodného kameňa môžete z hľadiska chémie bojovať veľmi ľahko. Soľ slabej kyseliny je potrebné ovplyvniť silnejšou kyselinou. Ten nahradzuje uhlie, ktoré je nestabilné a rozkladá sa na vodu a oxid uhličitý. Zloženie meradla môže obsahovať kremičitany a sírany a fosforečnany. Ale ak zničíte karbonátový „skelet“, tieto zlúčeniny nezostanú na povrchu.
Ako odvápňovacie činidlá sa tiež používajú kyselina adipová a anhydrid kyseliny maleínovej, ktoré sa pridávajú do vody. Tieto látky sú slabšie ako kyselina sulfámová, preto je pri odstraňovaní okovín nevyhnutný aj var.
Referencie:
Shpausus Z. Cesta do sveta chémie - Moskva: Vzdelanie, 1967 - 431s.
Kharlampovich G.D. a ďalšie. Mnohostranná chémia. - M.: Education, 1992.-159 s.
Khomchenko G.P. Učebnica chémie - M .: New Wave, 1996. - 304p.
Podobné eseje:
Štúdium vlastností zriedených roztokov polyarylátov s prihliadnutím na dva faktory: konformáciu makromolekúl v roztoku a orientačné poradie molekúl rozpúšťadla, ktoré ich rozpúšťajú, čo sa posudzovalo na základe termodynamických parametrov a štruktúry roztoku.
Účel a štruktúra paralelne presných ionitových filtrov prvého a druhého stupňa, zmiešané pôsobenie. Charakterizácia technológie protiprúdovej ionizácie. Opis sodíko-katiónovej metódy zmäkčovania vody. Zásady odsoľovania a odsoľovania vody.
Katiónové výmenníky a ich vlastnosti. Proces zmäkčovania vody pomocou kationizácie sodíka. Zmäkčovač vody na báze katiónu vodíka a sodíka. Metódy kalci-titu a čiastočnej katióny. Katexové filtre a pomocné zariadenia katexových zariadení.
Čo sú peny a povrchovo aktívne látky. Povrchové napätie ako najdôležitejšia charakteristika fázového rozhrania. Metódy experimentálnych štúdií vplyvu tvrdosti vody na penenie a stabilitu peny pre rôzne typy povrchovo aktívnych látok.
Vlastnosti vody a spôsoby jej zmäkčovania. Požiadavky na tvrdosť spotrebovanej vody v tepelnom a energetickom priemysle. Teoretické základy a metódy stanovenia tvrdosti vody pomocou komplexometrickej metódy. Odber vzoriek, reagenty, stanovenie.
Produkcia uhlíka tepelným rozkladom dreva, absorpcia rozpustených látok a plynov uhlím. Interakcia oxidu uhličitého so zásadami, tvorba oxidu uhoľnatého a štúdium jeho vlastností. Oboznámenie sa s vlastnosťami uhličitanov a hydrogenuhličitanov.
Podmienené ukazovatele kvality pitnej vody. Stanovenie organických látok vo vode, medi a olove. Metódy na odstránenie tvrdosti vody. Spôsoby, ako vyčistiť vodu. Príprava pracovného roztoku síranu draselného. Čistenie vody čiastočným zmrazením.
Chemické vlastnosti vápnika. Použitie čistého uhličitanu vápenatého v optike, vápenec v metalurgii - ako tavidlá. Sadra ako kryštalický hydrát síranu vápenatého. Vápenatá soľ kyseliny fosforečnej ako hlavná zložka fosforitanov a apatitov.
Rôzne uhlíkové zlúčeniny, ich distribúcia v prírode a použitie. Allotropické modifikácie. Fyzikálne vlastnosti a štruktúra voľného atómu uhlíka. Chemické vlastnosti uhlíka. Uhličitany a hydrogenuhličitany. Štruktúra diamantu a grafitu.
Charakterizácia litosféry, zloženie chemických prvkov a minerálov v zemskej kôre. Štruktúra, chemické zloženie a funkcie hydrosféry, atmosféra. Funkcie fotosyntézy organických látok vyskytujúcich sa v biosfére. Štúdium biogeochemických procesov.
Vysoká tvrdosť vody v systémoch vykurovania a teplej úžitkovej vody negatívne ovplyvňuje procesy prenosu tepla a zvyšuje spotrebu energie. Tvrdá pitná voda je okrem toho škodlivá pre ľudské zdravie. Pre vodu na rôzne účely sa používajú rôzne metódy zmäkčovania.
Zmäkčenie vody je proces odstraňovania solí tvrdosti z vody. Čo je to tvrdosť vody a prečo by sa mala odstraňovať?
Pojem tvrdosti vody sa zvyčajne spája s katiónmi vápnika (Ca 2+) a v menšej miere s horčíkom (Mg 2+). V skutočnosti všetky dvojmocné katióny do tej istej miery ovplyvňujú tuhosť. Interagujú s aniónmi a vytvárajú zlúčeniny (soli tvrdosti), ktoré sa môžu zrážať.
Soli železa, mangánu a stroncia sa tiež môžu vyzrážať, ale v skutočnosti majú všetky tieto prvky taký malý vplyv na tuhosť, že sú zvyčajne zanedbávané.
Hliník (Al 3+) a železité železo (Fe 3+) tiež ovplyvňujú tvrdosť, ale pri hladinách pH zistených v prírodných vodách je ich rozpustnosť, a teda „príspevok“ k tvrdosti, zanedbateľný. Podobne sa nezohľadňuje zanedbateľný účinok bária (Ba 2+).
Druhy tuhosti
Existuje niekoľko druhov tvrdosti vody. Celková tvrdosť je určená celkovou koncentráciou iónov vápnika a horčíka. Je to súčet tuhosti uhličitanu (dočasného) a neuhličitanu (trvalého).
Tvrdosť uhličitanu je spôsobená prítomnosťou uhľovodíkov a uhličitanov vo vode (pri pH\u003e 8,3). Dočasná tvrdosť je charakterizovaná prítomnosťou vo vode spolu s katiónmi Ca2 +, Mg2+ a Fe2+ uhľovodíkov alebo hydrogenuhličitanových aniónov (HCO3). Tento druh tvrdosti je takmer úplne odstránený vriacou vodou, a preto sa nazýva dočasná tvrdosť. Pri zahrievaní vody sa uhľovodíky rozkladajú na kyselinu uhličitú a zrážajú uhličitan vápenatý, hydroxid horečnatý a železo.
Nekarbonátová tvrdosť je spôsobená prítomnosťou solí vápnika a horčíka silných kyselín (sírová, dusičná, chlorovodíková) a neodstraňuje sa varom, preto dostala názov konštantná tvrdosť.
jednotky merania
Vo svetovej praxi sa používa niekoľko jednotiek tuhosti, pričom všetky sú navzájom korelované určitým spôsobom.
Jednotka tvrdosti sa považuje za tvrdosť vody, z toho v 1 litri obsahuje 1 mmol ekvivalentov Ca2+ alebo Mg2+. Jedna jednotka tvrdosti (1 mmol / l) zodpovedá obsahu iónov vápnika 20,04 mg / l alebo iónov horčíka 12,15 mg / l. Celková tvrdosť vody (H) sa môže vypočítať podľa vzorca:
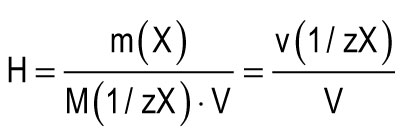
m (X) je hmotnosť rozpustenej látky, mg; M (1 / zX) je molárna hmotnosť ekvivalentu látky, mg / mmol (g / mol); V je objem vody, l; M (1 / zCa2 +) \u003d 20,04 mg / mmol; M (1 / zMg2+) \u003d 12,15 mg / mmol.
V tuzemsku sa okrem toho bežne používajú jednotky tuhosti, ako je nemecký stupeň (° d, dH), francúzsky stupeň (°), americký stupeň a ppm CaCO3.
Pomer týchto jednotiek tuhosti je uvedený v tabuľke. 1.
Tabuľka 1. Pomer rôznych jednotiek tuhosti
Jeden nemecký titul teda zodpovedá 10 mg / dm3 CaO alebo 17,86 mg / dm3 CaCO3 vo vode. Jeden francúzsky stupeň je 10 mg / dm3 CaCO3 vo vode a americký stupeň je ekvivalentný 1 mg / dm3 CaCO3 vo vode.
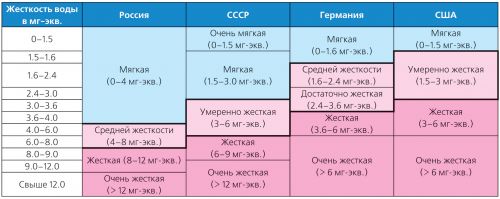
Tvrdosť vody sa veľmi líši a existuje veľa druhov klasifikácií. V Nemecku sa teda uplatňujú normy rigidity Nemeckého inštitútu pre normalizáciu (DIN 19643) av USA - klasifikácia prijatá Agentúrou na ochranu životného prostredia (USEPA) v roku 1986 (tabuľka 2).
Tabuľka 2. Klasifikácia rôznych typov tuhosti
Ktorá voda je mäkšia
Typicky v slabo mineralizovaných vodách tvrdosť prevažuje v dôsledku vápenatých iónov (hoci v niektorých zriedkavých prípadoch môže tvrdosť horčíka dosiahnuť 50 - 60%). So zvyšujúcim sa stupňom všeobecnej mineralizácie vody sa obsah vápnikových iónov (Ca2 +) rýchlo znižuje a zriedka prekračuje 1 g / l. Obsah iónov horčíka (Mg 2+) vo vysoko mineralizovaných vodách môže dosiahnuť niekoľko gramov av slaných jazerách - desiatky gramov na liter vody.
Tvrdosť povrchovej vody je vo všeobecnosti nižšia ako tvrdosť podzemnej vody. Tvrdosť povrchovej vody je vystavená výrazným sezónnym výkyvom, ktoré zvyčajne dosahujú najvyššiu hodnotu na konci zimy a najnižšiu počas povodne, keď sa hojne riedi jemným dažďom a roztopenou vodou. Morská a morská voda má veľmi vysokú tvrdosť (desiatky a stovky mekv / l).
Dôsledky tuhosti
Tvrdá pitná voda je horká kvôli horčíkovej chuti a má negatívny vplyv na tráviaci systém. Podľa štandardov Svetovej zdravotníckej organizácie (WHO) je optimálna tvrdosť pitnej vody 1,0 - 2,0 mEq / l.
Potravinové výrobky sa zle trávia v tvrdej vode, pretože katióny vápnika s potravinovými proteínmi tvoria nerozpustné zlúčeniny; ich výživová hodnota je znížená. Neustále používanie tvrdej vody môže viesť k ukladaniu solí (urolitiáza) v ľudskom tele.
Čaj a káva sa v takejto vode zle varia. V domácich podmienkach vedie prebytok solí s tvrdosťou k usadzovaniu vykurovacích povrchov v bojleroch, čajníkoch, potrubiach, ukladaní solí na vodovodných armatúrach a ich zlyhaní, zanecháva usadenie na vlasoch a pokožke osoby a vytvára nepríjemný pocit ich „tvrdosti“.
Tvrdosť vody použitej na prípravu rôznych produktov je jasne regulovaná a je na úrovni 0,1 - 0,2 mEq / l.
Tvrdá voda tvorí vodný kameň na stenách vykurovacích kotlov, batérií atď., Čo výrazne zhoršuje ich tepelný výkon, znižuje voľnú časť potrubí.
Potrubia sú zarastené usadeninami v mierke, takže ich produktivita niekoľkokrát klesá. Preto v tých procesoch, kde je povolené použitie vody s určitým obsahom soli, je jej tuhosť obmedzená na ešte nižšie hodnoty - 0,03 až 0,05 mEq / l.
Šupiny na ohrievačoch práčok ich vyradia z prevádzky. Pri umývaní, interakcii s povrchovo aktívnymi látkami (povrchovo aktívne látky) mydla alebo pracích prostriedkov ich soli tvrdosti ich viažu a vyžadujú vyššiu spotrebu. Tvrdú vodu nemožno použiť pri vykonávaní určitých technologických procesov, napríklad pri maľovaní, v elektrochémii atď.
Odstraňovanie soli
Procesy extrakcie solí Ca 2+ a Mg 2+ z úpravy vody vo vode sa nazývajú zmäkčovanie vody.
Relatívne selektívne odstránenie tvrdosti solí z vody sa môže vykonať metódami:
- tepelné spracovanie;
- destilácia;
- zmäkčenie činidla;
- zmrazenie;
- magnetické spracovanie;
- ultrazvukové spracovanie;
- iónová výmena;
- reverzná osmóza.
Známe sú aj spôsoby úpravy vody (elektromagnetické účinky, pridávanie polyfosforečnanov alebo iné „prostriedky proti tvorbe vodného kameňa“), ktoré umožňujú „viazať“ soli tvrdosti na určitý čas, čím sa predíde tomu, aby sa nejaký čas vypadávali vo forme vodného kameňa. Tieto metódy však chemicky neutralizujú soli tvrdosti, v skutočnosti ich neodstraňujú, a preto našli obmedzené použitie pri úprave priemyselnej vody.
Tepelné zmäkčenie
Týmto spôsobom sa zbavia dočasnej tuhosti spôsobenej uhličitanmi vápenatými a horečnatými. Pri vriacej vode sa uhľovodíky rozkladajú za vzniku zrazeniny stredného alebo zásaditého uhličitanu:
Ca (HCO3) 2 \u003d CaC03 ↓ + C02 + H20,
Mg (HCO3) 2 \u003d Mg2 (OH) 2C03 ↓ + 3CO2 + H20.
Výsledkom je znížená tvrdosť vody. Z tohto dôvodu sa tuhosť hydrogenuhličitanu nazýva dočasná.
U iónov železa je reakcia komplikovanejšia vzhľadom na skutočnosť, že FeCO3 je nestála látka vo vode. V prítomnosti kyslíka je konečným produktom reakčného reťazca Fe (OH) 3, čo je tmavočervená zrazenina. Preto čím viac železa vo vode, tým silnejšia je farba na stupnici, ktorá sa počas varu nanáša na steny a dno nádoby.
Preto pri vrení vody v každodennom živote dochádza súčasne k procesu jej čiastočného zmäkčovania.
destilácia
Destilácia je tradičná, účinná a spoľahlivá metóda, ktorá poskytuje vysoký stupeň čistenia vysoko slanej vody s vysokou slanosťou a tvrdosťou.
Všeobecný princíp získavania vody touto metódou je nasledujúci: predpripravená pitná voda vstupuje do destilátora, ktorý pozostáva z troch hlavných zložiek: odparky, kondenzátora a kolektora.
Odparovač s vodou sa zahrieva do varu. Vodná para vstupuje do kondenzátora, kde je skvapalnená a vo forme destilátu vstupuje do kolektora. Všetky neprchavé nečistoty prítomné v zdrojovej vode zostávajú v destilátore.
Na získanie vyčistenej vody sa používajú destilátory, ktoré sa navzájom líšia spôsobom ohrevu, produktivity a dizajnom.
Metóda jednoduchej destilácie je nehospodárna, pretože keď sa používa, sú vysoké náklady na energiu na zohrievanie a odparovanie (asi 3 000 kJ na 1 kg pary), ako aj spotreba vody na kondenzáciu pary (asi 8 litrov vody, 1 kg pary). Preto je pri nízkej spotrebe vody - 10 - 20 l / h vhodné použiť jednu destiláciu.
Účinnejšie a hospodárnejšie ako konvenčná destilácia sú vysokovýkonné viacstĺpcové destilátory. Sú však mimoriadne drahé, navyše sú pre nich vysoké náklady na predúpravu vody.
Je potrebné poznamenať, že destilačná metóda odstraňuje všetky rozpustené soli v zdrojovej vode.
Aplikácia činidla
Zmäkčovanie vody sa vykonáva metódou zmäkčovania sódou, vápnom a sódou.
Pri vápnení sa do roztoku pridáva hydratované vápno Ca (OH) 2 na pH asi 10. Výsledkom je, že reakcia prebieha:
Ca (HCO3) 2 + Ca (OH) 2 \u003d 2 CaC03 + 2H20,
Mg (HCO3) 2 + 2Ca (OH) 2 \u003d Mg (OH) 2 + 2СaC03 + 2nzO.
Táto metóda sa používa pre tvrdú vodu s vysokým obsahom uhličitanov a nízko uhličitanov, ak sa vyžaduje súčasné zníženie tvrdosti a zásaditosti. Zvyšková tuhosť je o 0,4 - 0,8 mekv / l vyššia ako uhličitanová tuhosť.
Keď sa pridá sodnovápenaté vápno, pridá sa do vody hasené vápno Ca (OH) 2 a uhličitan sodný Na2C03 na pH asi 10. Výsledkom sú nasledujúce reakcie:
Ca (HCO3) 2 + Ca (OH) 2 + Na2C03 \u003d 2 CaC03 + 2NaOH + H2C03,
Mg (HCO3) 2 + 2NaOH \u003d Mg (OH) 2 + 2NaHC03.
Ako vyplýva z reakčných rovníc, pri procese tvorby a sedimentácie sedimentu z vody sa extrahujú soli tvrdosti. Spolu s nimi sa odstránia koloidné a suspendované častice s pridruženým znečistením. Organický sediment je čiastočne sorbovaný na vločkách vločiek.
S vápnom sódy sa vďaka prebytku iónov HCO 3 dosiahne väčšia úplnosť odstránenia solí tvrdosti z vody. Zvýšenie teploty na 70 - 80 ° C vám umožní zvýšiť zvyškovú tuhosť na 0,35 - 1,0 mEq / L. Rovnaký výsledok sa dá dosiahnuť zvýšením dávok reagencií.
Soda Soda
Ak je tvrdosť bez uhličitanu vyššia ako uhličitan, je potrebné pridať sódu. Ak sú tieto parametre rovnaké, pridanie sódy nemusí byť vôbec potrebné.
Uhľovodíky vápnika a horčíka v reakcii s alkáliami tvoria ťažko rozpustné zlúčeniny vápnika a horčíka, sódy, vody a oxidu uhličitého:
Ca (HCO3) 2 + 2NOH \u003d CaC03 ↓ + Na2C03 + 2H20,
Mg (HCO3) 2 + 2NOH \u003d Mg (OH) 2 ↓ + Na2C03 + H20 + C02.
Oxid uhličitý, ktorý vznikol reakciou hydrogenuhličitanu horečnatého s alkáliou, znova reaguje s alkáliou za vzniku sódy a vody:
C02 + NaOH \u003d Na2C03 + H20.
Nekarbonátová tvrdosť
Síran a chlorid vápenatý reagujú s sódou vytvorenou pri reakciách tvrdosti uhličitanu a alkálií a pridanou sódou za vzniku uhličitanu vápenatého, ktorý sa nelepí na zásadité podmienky:
CaCl2 + Na2C03 \u003d CaC03 ↓ + 2NaCl,
CaSO4 + Na2C03 \u003d CaC03 ↓ + Na2S04.
Síran horečnatý a chlorid reagujú s alkáliami za vzniku vyzrážaného hydroxidu horečnatého:
MgS04 + 2NaOH \u003d Mg (OH) 2 ↓ + Na2S04,
MgCl2 + 2NaOH \u003d Mg (OH) 2 ↓ + 2NaCl.
Vzhľadom na to, že pri reakciách hydrogenuhličitanu s alkáliou sa tvorí sóda, ktorá následne reaguje s tvrdou bez uhličitanu, musí byť jej množstvo korelované v pomere tvrdosti uhličitanu (LFA) a uhličitanu (LFA):
- ak sú si rovní, môže sa soda vynechať;
- za podmienky Lc\u003e Lnc sa vytvorí nadbytok sódy;
- s pomerom LCD< Жнк - недостаток соды и ее необходимо добавлять.
Depozičné procesy sa uskutočňujú v sedimentačných nádržiach a odlučovačoch so suspendovanou vrstvou sedimentu.
Sedimentačné nádrže sú neúčinné a hydroxidová buničina získaná v nich má vysokú vlhkosť 97 až 99%. Preto sa v súčasnosti prakticky nepoužívajú.
V praxi sa používajú rôzne verzie odlučovačov so suspendovanou vrstvou sedimentu. V nich je roztok, ktorý sa má čistiť, dodávaný zdola a prechádza vrstvou sedimentu. To zvyšuje koeficient čistenia vody.
Pri príprave pitnej vody sa nepoužívajú reagenčné metódy. Po nich má voda silne zásaditú reakciu. Preto sa činidlá často používajú v energetike a priemysle ako prvý stupeň čistenia mechanických filtrov. Pri spoločnej práci vám umožňujú zmäkčiť vodu, odstrániť suspendované pevné látky vrátane koloidov a čiastočne vyčistiť vodu z organických látok.
mrazivý
Na boj proti konštantnej tvrdosti vody sa používa metóda, napríklad zamrznutie ľadu. Na to stačí vodu postupne zamrznúť. Ak zostane z pôvodného množstva približne 10% kvapaliny, je potrebné vypustiť nezmrznutú vodu a ľad opäť obrátiť na vodu. Všetky soli, ktoré tvoria tvrdosť, zostávajú v nezmrazenej vode.
Spolu s destiláciou je to zároveň jeden zo spôsobov, ako odsoliť vysoko slanú vodu na pitnú kvalitu.
Iné metódy
Metóda elektrodialýzy je založená na fenoméne riadeného pohybu elektrolytových iónov k elektródam pripojeným na sieť jednosmerného prúdu. Kovové ióny, ktoré určujú tvrdosť vody, sú teda zachytávané na elektródach a sú oddelené od vody opúšťajúcej zariadenie na úpravu vody.
Metóda magnetickej ionizácie využíva aj fenomén riadeného pohybu iónov, ale už pod vplyvom magnetického poľa. Aby sa zvýšil počet iónov vo vode, predbežne sa ožaruje ionizujúcim žiarením.
Magnetické čistenie vody spočíva v tom, že voda prechádza systémom magnetických polí opačných smerov. V dôsledku toho dochádza k zníženiu stupňa hydratácie rozpustených látok a ich kombinácie na väčšie častice, ktoré sa zrážajú.
Ultrazvukové čistenie vody tiež vedie k tvorbe väčších častíc rozpustených látok s tvorbou sedimentu.
Je vhodné podrobne sa zaoberať metódou iónovej výmeny a reverznou osmózou v druhej časti článku, ktorú uverejníme v našom časopise v ďalšom čísle.
