Ūdens cietība un tās novēršana. IA apakšgrupas metālu uzdevumi un vingrinājumi
1. lappuse
Pagaidu cietības novēršanu veic ar verdošu ūdeni. Viršanas laikā ogļūdeņraži tiek iznīcināti, un veidojas slikti šķīstošie karbonāti. Kad ūdenī tiek ievadīts nātrija karbonāts, kalcija hidroksīds, tiek noņemta kopējā ūdens cietība. Šajā gadījumā karbonātu cietību novērš kaļķi, un bezkarbonātu cietību novērš ar sodu.
Papildus īslaicīgas cietības novēršanai kaļķi no ūdens izgulsnē visu magniju un dzelzi un veicina organisko un neorganisko koloīdu koagulāciju.
Pēc piemaisījumu tīrīšanas, novēršot īslaicīgu cietību un gaisa attīrīšanu, dekoratīvais ūdens tiek ievietots siltummainī (2), kur tas tiek uzkarsēts līdz 335 K. Pēc sajaukšanas papildināšanas un atgriešanās ūdens tiek sūknēts uz siltummaiņa (2) otro zonu, kur tas tiek uzkarsēts līdz 355 K un ieplūst. siltumtīkli.
Mīkstināšanu bieži izmanto, lai novērstu īslaicīgu ūdens cietību, kas paredzēta, lai kompensētu zaudējumus (uzlādēšanu) slēgtās cirkulējošās ūdens apgādes sistēmās un novērstu siltummaiņas un dzesēšanas virsmu minerālu aizsērēšanu saskarē ar cirkulējošu ūdeni. Daudzos gadījumos dekoratīvais ūdens ir galvenais kalcija jonu un biokarbonātu uzkrāšanās avots pārstrādātā ūdenī, kas sistēmās ar augstiem iztvaikošanas koeficientiem var izjaukt stabilu pārstrādāta ūdens sastāvu.
Ūdens mīkstināšanu, lai novērstu īslaicīgu cietību, veic ķīmiski, ievadot reaģentus, kurus izmanto kā kaļķi, sērskābi vai sālsskābi. Ar ķīmiskām metodēm tiek panākts salīdzinoši sekla ūdens mīkstināšana. Augstākai mīkstināšanai tiek izmantotas katjonu apmaiņas metodes, kuru būtība ir izmantot noteiktu vielu spēju apmainīt tajās esošā nātrija katjonus pret cietības sāļu katjoniem ūdenī.
Kaustisko sodu izmanto termoelektrostacijās, lai novērstu īslaicīgu ūdens cietību, anovītisko filtru reģenerācijai, ko augos izmanto ūdens ķīmiskai atsāļošanai.
Kaustisko sodu izmanto termoelektrostacijās, lai novērstu īslaicīgu ūdens cietību un reģenerētu anjonu filtrus, ko izmanto ķīmiskās atsāļošanas iekārtās.
Līdzīgi jāaprēķina arī Ca (OH) 2 daudzums, kas nepieciešams īslaicīgas stingrības novēršanai.
Kāpēc, lai novērstu īslaicīgu stingrību magnija sāļu dēļ, ir nepieciešams vairāk kaļķu, nekā pagaidu kalcija sāļu radītais stingrums.
Tāpēc, lai uzlādētu slēgtas (bez attīrīšanas) ūdens apgādes sistēmas, jāveic relatīvi dziļa papildināšanas ūdens mīkstināšana un pagaidu cietības novēršana.
Neliela daudzuma sārmainu reaģentu ieviešana palielina ūdens magnētiskās apstrādes efektivitāti, kaut arī sārmainu reaģentu ieviešana, piemēram, kaļķa daudzumā, kas nepārsniedz 10 - 20% no tiem, kas nepieciešami pagaidu stingruma novēršanai, saskaņā ar KhIEI 1959. gadā veiktajiem pētījumiem samazina skalas veidošanos. 8 līdz 10 reizes.
Šajā gadījumā tiek izvadīts bikarbonātu izraisītais ūdens no sešiem kauliem. Tāpēc šādu stīvumu sauc par īslaicīgu vai bikarbonātu. Tāpēc, lai novērstu īslaicīgu stingrību, pietiek ar ūdens vārīšanu.
Pastāvīgas cietības sāļus, piemēram, CaCl, CaSO4 utt., Karsējot, no ūdens neizņem. Tie izgulsnējas ūdens iztvaikošanas laikā, veidojot uz aparāta sienām grūti noņemt blīvu skalu. Cietais ūdens var tikt izmantots tikai tajos gadījumos, kad tā lietošanas apstākļi neizraisa cietu nogulšņu nokrišņus, piemēram, ledusskapjos, kur dzesēšanas ūdens nesasilda līdz temperatūrai, kas palīdz novērst pagaidu cietību. Katlu darbnīcās, kur ūdens tiek ne tikai sildīts, bet arī iztvaikojis, ir nepieņemama ne tikai īslaicīga, bet arī pastāvīga cietība. Tāpēc tiem paredzēto ūdeni provizoriski attīra no kalcija un magnija sāļiem ar ķīmisku metodi īpašos augos.
Pašvaldības izglītības iestāde
"1. vidusskolas numurs
ar atsevišķu priekšmetu padziļinātu izpēti
Adrese: Belgorodas apgabals,
Ūdens cietības pārbaude
un veidi, kā to novērst
skolēns 11 "A" klases SM; vidējais
vidusskolas numurs 1
ar padziļinātu pētījumu
atsevišķi priekšmeti
Adrese: Belgorodas apgabals,
Zinātniskais konsultants :,
ķīmijas skolotājs
vidusskolas numurs 1
ar padziļinātu pētījumu
atsevišķi priekšmeti
novy Oskol, Belgorodas apgabals
Adrese: Belgorodas apgabals,
novy Oskol,
novy Oskol
1. Ievads ………………………………………………………………… .3
2. Ūdens cietība un metodes tās novēršanai …………………………… .4
· Kāpēc ūdens kļūst ciets ..................................................... 4
· Ūdens cietības vērtība cilvēku dzīvē ...................................... 4
· Stīvuma novēršanas veidi ……………………………………… ... 5
3. Ūdens cietības izpēte un metodes tās novēršanai .................. 8
4. Secinājumi un secinājumi
5. Atsauču saraksts
Ievads
Kas studēja zinātnes, bet tās nepiemēro,
līdzīgi tam, kurš arkls, bet nesēj.
Saadi
20. gadsimta 80. gados parādījās Pola Čepija Braga grāmatas par veselīga dzīvesveida popularizēšanu. Un, lai arī daudzi zinātnieki viņa viedokli uzskata par pretrunīgu, Pola Braga grāmatas ir pelnījušas uzmanību. Viena no viņa grāmatas sadaļām (Mani pirmie eksperimenti ar cietību) ir veltīta ūdens cietības problēmai, kur autore savos memuāros apraksta sava vectēva, kurš nomira no tā, ka viņa asinsvadi pārtapa no cieta ūdens, un sievietes, kas dzīvoja to daļās, slimības. neveiksmīgo sievieti sauca par akmens sievieti, jo viņas ķermeni burtiski pārakmeņoja liels daudzums sāļu). Šī sieviete bija viena no daudzajām cietā ūdens upurēm. Neveiksmīgie orgāni nespēja tikt galā ar liela daudzuma neorganisko vielu pārstrādi, kas atrodas šādā ūdenī, un viņi ļoti aktīvi sāka uzkrāties viņas ķermenī.
Kalcija savienojumi mūsu ķermenī izgulsnējas nierakmeņu un žultspūšļa formā.
Mūsdienās ūdens apstrāde nav kaprīze un lutināšana, bet drīzāk būtiska nepieciešamība. Fakts ir tāds, ka tādas nepatīkamas parādības kā putas, trešo personu smakas, smakas, kā arī duļķains nogulsnes ne tikai rada daudz neērtības, bet arī rada daudzas slimības. Zemas kvalitātes ūdens veicina sāļu nogulsnēšanos, paātrina ķermeņa novecošanās procesu un kļūst par iemeslu daudzu slimību pārejai uz hronisko stadiju. Turklāt hlors satur vairākas vielas, kas var izraisīt vēzi. Bet ūdens ir visas dzīves pamats, un neviens ūdens organisms nevar iztikt bez ūdens. Piemēram, cilvēks sastāv no ūdens, kura koncentrācija ir 60–65%. Tāpēc tīrs ūdens ir ļoti svarīgs katram cilvēkam. Diemžēl dabīgais ūdens mūsu laikā ir pilnīgi nepiemērots patēriņam bez iepriekšējas apstrādes, ko apstiprina dažādas ūdens analīzes. Ikviens zina, ka filtrācijas stacijām, kuras it kā veic ūdens attīrīšanu, jau sen vajadzēja veikt kapitālu remontu, un ūdens apgādes sistēmām, caur kurām mūsu mājās tiek piegādāts ūdens, ir jāmaina.
Mūsu darba mērķis bija izpētīt ūdens cietības līmeni mūsu dzimtajā pilsētā.
Ūdens cietība un metodes tās novēršanai
Kāpēc ūdens kļūst ciets?
Kalcijs un tā savienojumi ir ļoti nepieciešami ķermenim: tieši no kalcija ortofosfāta Ca3 (P04) 2 veido cilvēku un dzīvnieku kaulus un zobus. Tie veidojas no šķīstošiem kalcija savienojumiem, kas asinis pārvadā visā ķermenī. Pateicoties kalcija katjoniem Ca2 +, asinis spēj sarecēt, veidojot recekļus, aizsērējot brūces un apturot asiņošanu.
Kalcija savienojumi ir ne tikai noderīgi, bet arī ļoti kaitīgi - piemēram, ja tie parastajam ūdenim piešķir cietību. Ikdienā vārdu "stīvums", no pirmā acu uzmetiena, var attiecināt tikai uz cietām vielām: parka sols vai ķeblis virtuvē var būt ciets. Tomēr ūdens ir arī ciets.
Galvenais magnija un kalcija sāļu avots, kas nonāk ūdenī, ir kaļķakmens, ģipša un dolomīta nogulsnes, ko iznīcina dabiskie ūdeņi.
Zemūdens sāļos ūdeņos lielākā daļa kalcija jonu. Palielinoties mineralizācijas pakāpei, kalcija jonu saturs strauji samazinās un reti pārsniedz 1 g / l. Magnija jonu saturs mineralizētajos ūdeņos var sasniegt vairākus gramus, bet sālsūdenī - vairākus desmitus gramus.
Ūdens cietība - ūdens ķīmisko un fizikālo īpašību kombinācija, kas saistīta ar sārmzemju metālu izšķīdušo sāļu, galvenokārt kalcija un magnija, saturu tajā. Ūdeni ar augstu šādu sāļu saturu sauc par cieto ūdeni, ar zemu saturu - mīksto. Pastāv īslaicīga stingrība (karbonāts), ko veido hidrokarbonāti, un pastāvīga stingrība (bez karbonāta), ko izraisa citu sāļu klātbūtne. Pagaidu stīvums ir saistīts ar kalcija un magnija bikarbonātu (Ca (HCO3) 2; Mg (HCO3) 2) klātbūtni ūdenī. Pastāvīga ūdens cietība ir saistīta ar sulfātu, Ca un Mg hlorīdu (CaSO4, CaCl2, MgSO4, MgCl2) klātbūtni ūdenī.
Ūdens cietības vērtība cilvēka dzīvē
Ūdens cietība ir ūdenī izšķīdušā kalcija jonu Ca2 + un magnija Mg2 + summa.
Kalcija un magnija joni nedara lielu kaitējumu dzīviem organismiem, taču to klātbūtne lielos daudzumos ūdenī nav vēlama, jo šāds ūdens nav piemērots sadzīves vajadzībām.
Cietā ūdenī ziepju un pulvera patēriņš palielinās, mazgājot drēbes, gaļu un dārzeņus lēnām sagremot, un samazinās kuņģa kustīgums. Cietais ūdens nav piemērots ūdens apgādes sistēmām un ūdens sildīšanas iekārtām.
Cietību mēra miligramos ekvivalenta litrā (mEq / L). Nozares standarti pieļaujamajām stinguma vērtībām ir atkarīgi no izmantotā aprīkojuma veida. Parasti tiek ņemts vērā cietais ūdens ar cietību 1 mEq / L vai vairāk.
Cietība ir visizplatītākā ūdens kvalitātes problēma. Sākotnēji termins “cietais ūdens” tika lietots ūdenim, kuru bija grūti mazgāt.
Ciets ūdens, mazgājot, sausina ādu, izmantojot ziepes, tajā slikti veidojas putas. Cieta ūdens izmantošana rada nogulumus (mērogu) veidošanos uz katlu sienām, caurulēs utt. Tajā pašā laikā pārāk mīksta ūdens lietošana var izraisīt cauruļu koroziju, jo šajā gadījumā nav skābju-bāzes buferizācijas, ko nodrošina hidrokarbonāts. (īslaicīgs) stīvums. Cieta vai mīksta ūdens patērēšana parasti nav bīstama veselībai, lai gan ir pierādījumi, ka augsta stingrība veicina urīna akmeņu veidošanos, bet zema - nedaudz palielina sirds un asinsvadu slimību risku.
Dabisko ūdeņu cietība var mainīties diezgan plaši, un tā ir nestabila visu gadu. Cietība palielinās ūdens iztvaikošanas dēļ, samazinās lietus sezonā, kā arī sniega un ledus kušanas laikā.
Stīvuma novēršanas veidi
Atšķirt kopumā stīvums, kas sastāv no īslaicīgs un nemainīgs.
Vārīšanās.
Pagaidu stingrība (vienreizēja vai karbonāta) rodas Ca (HCO3) 2 un Mg (HCO3) 2 bikarbonātu klātbūtnes dēļ ūdenī. Oglekļa cietību ir viegli noņemt verdošs ūdenskurā Ca2 + un Mg2 + tiek noņemti, veidojot nešķīstošas \u200b\u200bnogulsnes:
Ca (HCO3) 2 CaCO3 ↓ + CO2 + H2O
Mg joni izgulsnējas bāzes karbonāta vai magnija hidroksīda formā (pie pH\u003e 10,3).
2Mg2 + + OH) 2CO3 ↓ + CO2 + H2O
(OH-joni veidojas jonu mijiedarbības dēļ ar ūdeni: un karsējot līdzsvars mainās pa labi).
Lai samazinātu karbonātu cietību kaļķošanas metode kurā tiek ievadīts apstrādātais ūdens kaļķiCa (OH) 2. Reakcijas, kas rodas, ieviešot kaļķi, var uzrakstīt molekulārā formā:
Ca (HCO3) 2 + Ca (OH) 2 → 2CaCO3 ↓ + H2O
Mg (НСО3) 2 + Са (ОН) 2 → Mg (ОН) 2 ↓ + 2СаСО3 + Н2О
Vārajot ūdeni, tiek saglabāta nemainīga cietība (neatgūstama vai nesatur karbonātu), jo pastāvīga cietība ir saistīta ar sulfātu, hlorīdu un citu Ca un Mg sāļu klātbūtni ūdenī. Kvantitatīvi tas ir vienāds ar Ca2 + un Mg2 + jonu koncentrāciju mīnus laika cietība. Parasti izmanto, lai samazinātu karbonātu cietību. kalcinēts soda (Na2CO3):
MgSO4 + Na2CO3 → MgCO3 ↓ + Na2SO4
Kamēr pievienoju kaļķi un soda jūs varat atbrīvoties no karbonāta un bezkarbonāta cietības ( kaļķu-sodas metode).
Visa stingrība tiek novērsta pat ar ievads nātrija fosfāts, nātrija tetraborāts tā kā ortofosfāti ir mazāk šķīstoši nekā karbonāti, tos ērtāk izmantot ūdens mīkstināšanai:
3CaSO4 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 3Na2SO4
Mūsdienu ūdens mīkstināšanas veids ir balstīts uz izmantojot jonu apmaiņas sveķi - jonu apmainītāji (katjonu un anjonu apmainītāji). Katjonu apmainītāji ir sintētiski jonu apmaiņas sveķi - aluminosilikāti, piemēram:
To sastāvu nosacīti var izteikt ar vispārīgo formulu Na2R, kur Na + ir izteikti mobilais katjons un R - ir katjonu apmaiņas daļiņa, kurai ir negatīva maksa.
Kad cietais ūdens plūst caur katjonu apmaiņas sveķu slāni, katjonus apmaina atbilstoši reakcijām:
Ca2 + + Na2R → 2Na + + CaR
Mg2 + + + Na2R → 2Na + + MgR
Tādējādi Ca2 + un Mg2 + joni no šķīduma pāriet katjonu apmaiņas sveķos. Katjonu apmaiņas sveķus atjauno, tos mazgā ar koncentrētu NaCl šķīdumu:
CaR + 2NaCl → CaCl2 + Na2R
Pēc mazgāšanas katjonu apmaiņas sveķus var atkal izmantot, lai notīrītu ūdeni no ūdens.
Apgrieztā osmoze. Metode ir balstīta uz ūdens caurlaidību caur puscaurlaidīgām membrānām (parasti poliamīdu). Kopā ar cietības sāļiem tiek noņemta arī lielākā daļa citu sāļu. Tīrīšanas efektivitāte var sasniegt 99,9%. Šī metode ir atradusi vislielāko pielietojumu sadzīves dzeramā ūdens attīrīšanas sistēmās. Kā šīs metodes trūkums jāatzīmē nepieciešamība iepriekš sagatavot ūdeni, kas tiek piegādāts reversās osmozes membrānai.
Elektrodialīze Tā pamatā ir sāļu noņemšana no ūdens ar elektriskā lauka iedarbību. Izšķīdušo vielu jonu noņemšana notiek īpašu membrānu dēļ. Līdzīgi kā ar reversās osmozes tehnoloģiju, papildus cietības joniem tiek noņemti arī citi sāļi.
Termiskā metode. Balstoties uz ūdens sildīšanu, novērš tikai īslaicīgu (karbonāta) stingrību. Atrod pielietojumu ikdienas dzīvē. Rūpniecībā to izmanto, piemēram, termoelektrostacijās.
Reaģenta mīkstināšana. Metodes pamatā ir sodas vai nolaistā kaļķa pievienošana ūdenim. Šajā gadījumā kalcija un magnija sāļi nonāk nešķīstošos savienojumos un rezultātā izgulsnējas. Šī metode ir pamatota ar salīdzinoši lielu ūdens patēriņu, jo tā ir saistīta ar daudzu īpašu problēmu risināšanu: nogulšņu filtrēšana, precīza reaģenta deva.
Katjonizācija. Metodes pamatā ir jonu apmaiņas granulu iekraušana (visbiežāk jonu apmaiņas sveķi). Šāds kontakts, nonākot saskarē ar ūdeni, absorbē cietības sāļu (kalcija un magnija) katjonus. Apmaiņā, atkarībā no jonu formas, dodot prom nātrija vai ūdeņraža jonus. Šīs metodes attiecīgi sauc par Na-katjonu un H-katjonu. Parasti ūdens cietība samazinās ar vienpakāpes nātrija katjonu līdz 0,05–0,1 mEq / L, ar divpakāpju - līdz 0,01 mEq / L.
Labākais reaģents Ūdens cietības novēršanai nātrija otofosfāts ir Na3PO4: 3Ca (HCO3) 2 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 6NaHCO3 3MgSO4 + 2Na3PO4 → Mg3 (PO4) 2 ↓ + 3Na2SO4. Kalcija un magnija ortofosfāti ir ļoti slikti labāka ūdens mīkstināšana. Rūpniecībā, izmantojot jonu apmaiņas filtrus, kalcija un magnija jonus aizstāj ar nātrija un kālija joniem, lai iegūtu mīkstu ūdeni. Mājsaimniecības dzeramā ūdens filtros notiek zināma ūdens mīkstināšana. Filtrēts ūdens dod mazāku mērogu. Ūdeni var pilnībā attīrīt, destilējot (destilējot).
Mūsdienās ir lieliski ūdens filtri kuras tiek uzstādītas dzīvoklī bez problēmām un kalpo kā lielisks līdzeklis augstas kvalitātes ūdens attīrīšanai. Iespējams, ka daudzi šodien lielveikalos labprātāk pērk tīru ūdeni pudelēs. Šāda ūdens izvēle ir patiesi milzīga, bet vai ir iespējams būt 100% pārliecinātam par tā kvalitāti? Varbūt nē! Tāpēc ūdens attīrīšana ar speciāli attīrīšanai paredzētu filtru palīdzību ir optimālākais risinājums mūsdienu cilvēkam, kurš rūpējas par savu un savu tuvinieku veselību. Ūdens attīrīšanas sistēmas ir ļoti dažādas. Parasti tie atšķiras: veiktspēja, daži parametri, ūdens attīrīšanas pakāpe, kā arī dizains. Ūdens filtri lieliski attīra ūdeni un padara to piemērotu dzeršanai, samazina alumīnija, dzelzs, mangāna, hlora un visu veidu nitrātu saturu tajā. Turklāt ūdens attīrīšanas filtri palīdz novērst nepatīkamo smaku, garšu, kā arī atbrīvoties no baktērijām un baktērijām, kas atrodas ūdenī. Ūdens, kas attīrīts caur šādām sistēmām, kļūst mazāk stingrs, tomēr tas nezaudē cilvēka ķermenim nepieciešamās derīgās vielas. Ūdens filtri ir lieliska iespēja saņemt attīrītu ūdeni neierobežotā daudzumā, neizejot no mājām. Pareizi izvēlēts filtrs būs lielisks risinājums tīra ūdens problēmai, uzlabos veselību un pagarinās jūsu ilgmūžību.
Ūdens cietības izpēte un metodes tās novēršanai
Ūdens cietība ir saistīta ar Ca2 + un Mg2 + jonu klātbūtni. Jo lielāks to saturs dabiskajā ūdenī (ūdenī, kas iziet cauri kaļķainiem iežiem un augsnēm), jo lielāka tā cietība.
Kvantitatīvi ūdens cietību izsaka kā Ca2 + un Mg2 + jonu miliekvivalentu summu vienā litrā ūdens (meq / l). Viena cietības miliekvivalente atbilst 20,04 mg / L Ca2 + jonu saturam vai 12,16 mg / L Mg2 + jonu saturam.
Tāpēc, risinot problēmas, varat izmantot formulu:
(mmol - ekvivalents / l),
kur m - tās vielas masa, kas veido ūdens cietību vai ko izmanto ūdens cietības novēršanai, mg;
Mā- šīs vielas ekvivalentā masa, g / mol;
V- ūdens tilpums, l
Pēc cietības visi dabiskie ūdeņi ir sadalīti mīksts(kopējā cietība mazāka par 2 mmol / l) un grūtsar vidējo stingrības pakāpi (2-10 mmol / l) un augstu stingrības pakāpi (vairāk nekā 10 mmol / l).
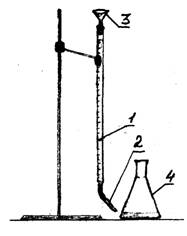
1 - birete
2 - pilinātājs
3 - piltuve
1. attēls - eksperimentālā iestatīšana
Izrādes pieredze
Trīs kolbās ar lielu graduētu balonu mēra 100 ml ūdens. Katrā kolbā ar ūdeni pievieno 2-3 pilienus metiloranža indikatora. Titrēšanu veic 0,1 N. sālsskābes šķīdums, izmantojot bireti. Iestatiet skābes līmeni biretē uz nulles dalījumu. Pilienīgi ielejiet sālsskābi, līdz šķīduma krāsa mainās no dzeltenas līdz oranži rozā. Reģistrē skābes daudzumu, kas nonācis titrēšanā. Atkārtojiet titrēšanu vēl divas reizes. Ievadiet datus tabulā.
Aprēķins tiek veikts pēc formulas:
![]() (mmol - ekvivalents / l),
(mmol - ekvivalents / l),
kur ir normālā sālsskābes koncentrācija;
Vcp ( HCl) - vidējais tilpums HCl aizgājuši titrēšanai;
Vwater - titrēšanai ņemtais ūdens daudzums.
Iegūtos datus mēs izstrādājām tabulas veidā.
Ūdens paraugs
izmanto titrēšanai
izmanto filtrētā ūdens titrēšanai
Krāna ūdens - ķīmijas kabinets
Ūdens no krāna - st. Aviācija
Ūdens no krāna - st. Oktobris
Ūdens no kolonnas - p
Ūdens no krāna - st. Pokrovskis
Ūdens no akas - st. Pokrovskis
Ūdens no krāna - st. Belgoroda
Ūdens no krāna - st. Karavīrs
Sodas ūdens "Skaists"
Skolas laboratorijas apstākļos mēs veica pētījumu par ūdens cietību, kas ņemts no dažādiem avotiem. Cietības noteikšanai tika izmantots dabiskā ūdens titrēšana ar sālsskābi metiloranža indikatora klātbūtnē. Ūdens parauga karbonāta cietība tika noteikta pirms un pēc tam, kad tas tika izvadīts caur sadzīves filtru (tika izmantots Aquaphor).
Darba rezultātā tika izdarīti šādi secinājumi:
1) Ūdens Novy Oskol pilsētā ir grūti (W \u003d 7-10,5). Daudzi cilvēki dzīvo privātajā sektorā un izmanto ūdeni no akām, un šis ūdens ir ļoti ciets.
2) Ūdens, kas nonāk ūdensapgādē, tiek attīrīts un mīkstināts (L \u003d 6-7), tāpēc to var uzskatīt par vidēju cietību (saskaņā ar GOST dzeramā ūdens kopējā cietība nedrīkst būt lielāka par 7 mmol / l).
3) Vienkāršākais mājās gatavotais ūdens mīkstināšanas veids ir vārīšana.
4) Eksperimenti parādīja, ka mājsaimniecības filtri arī lieliski mīkstina ūdeni. Tātad, pētījumiem ņemtais ūdens no akas uz ul. Pokrovskim (cietība 10,5 mmol / L) pēc filtrēšanas cietība bija tikai 2 mmol / L, kas ir pat zemāka par fizioloģisko normu (3,5 mmol / L). Tādējādi ūdens filtri ir lieliska iespēja saņemt attīrītu ūdeni neierobežotā daudzumā, neizejot no mājām.
Atsauču saraksts
1.,. praktisko higiēnas vingrinājumu rokasgrāmata ar sanitāro pētījumu tehniku. - M.: “Medicīna”, 19. gs.
2. un. Ķīmiskās analīzes pamati. Studiju rokasgrāmata studentiem. - M .: "apgaismība", 1971. - 192 lpp.
3 .. Neorganiskā ķīmija: mācību grāmata. tehnologam īpašs universitātes. - M .: Augstāks. skola., 1989 .-- 432 lpp.
4.,. Mēs uzraugām mūsu pilsētas vidi: 9.-11.klase: skolas seminārs. - M .: Cilvēce. ed. VLADOS centrs, 2001. - 112. lpp.
5. Ķīmija: atsauce ed./V. Šrēters, K.-H. Lautenschleger, H. Bibrak et al .: Per. ar to._ M .: Ķīmija, 1989. - Per. ed .: GDR, 1986.- 648 lpp.
Pārvērtības ķēdes
1. Kalcija karbonāts Kalcija oksīds Kalcija hidroksīds Kalcija karbonāts Kalcija nitrāts.
2. Magnija sulfāts magnija nitrāts magnija oksīds magnija acetāts.
3. Kalcija hlorīds Kalcija sulfāts Kalcija sulfīds Kalcija sulfāts Kalcija hidroksīds Kalcija oksīds Kalcija hidrokarbonāts.
4. Magnijs Magnija oksīds Magnija hidroksīds Magnija hlorīds Magnija hidroksikarbonāts Magnija sulfāts Magnija hidroksīds.
5. Magnija sulfīds magnija oksīds ... magnija hidroksīds ... magnija nitrāts.
6. Kalcija kalcija hidroksīds Kalcija karbonāts Kalcija oksīds Kalcija karbīds Kalcija hidroksīds Kalcija hidrokarbonāts.
Norēķinu uzdevumi
A līmenis
1. 13,7 g metāla mijiedarbības ar ūdeni izdalās 2,24 litri gāzes (n.a.). Identificējiet metālu. Kādas nogulsnes un kādā daudzumā veidojas, ja iegūtajam šķīdumam pievieno nātrija sulfāta pārpalikumu?
Risinājums
M Ia un IIa apakšgrupu mijiedarbības laikā ar ūdeni izdalās gāze (H 2).
Saskaņā ar ekvivalentu likumu:
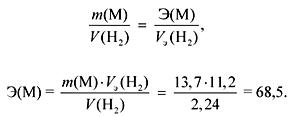
Ja M Ia apakšgrupas, tad
A r (M) \u003d E valence \u003d 68,5 (tāda metāla nav).
Ja M IIa apakšgrupas, tad
A r (M) \u003d E valence \u003d 137 (Ba).
Ba + 2H 2 O \u003d Ba (OH) 2 + H 2,
Ba (OH) 2 + Na2SO4 \u003d BaSO4 + 2NaOH,
(BaSO4) \u003d (Ba (OH) 2) \u003d (Ba) \u003d\u003d 0,1 mol,
m(BaSO 4) \u003d M\u003d 0,1 233 \u003d 23,3 g.
Atbilde. Metāls - Ba; m(BaSO 4) \u003d 23,3 g.
2. Kāds tilpums 0,5 M kalcija hidroksīda šķīduma jāpievieno 81 g 10% kalcija bikarbonāta šķīduma (blīvums 1 g / cm 3), lai pabeigtu nogulumu veidošanos? Nosaka nogulšņu masu.
Atbilde. 100 ml Ca (OH) 2, 10 g CaCO 3.
3. Šķīdumu, kas satur 23,3 g kālija sulfāta un hromāta maisījuma, ietekmē bārija hlorīda pārpalikums. Nogulsnes izfiltrē, mazgā, pēc tam tām pievieno sālsskābes pārpalikumu. Daļa nogulsņu izšķīdināja, atlikušo daļu filtrēja, mazgā un žāvē. Nokrišņu masa pēc žāvēšanas bija 23,3 g. Nosakiet sākotnējā maisījuma sastāvu.
Atbilde. 17,4 g K2S04 un 5,9 g K2C04.
4. Ir kalcija, kalcija oksīda un kalcija karbīda maisījums ar sastāvdaļu molāro attiecību 1: 3: 4 (uzskaitīšanas secībā). Kāds ūdens daudzums var nonākt ķīmiskā mijiedarbībā ar 35 g šāda maisījuma?
Atbilde. 17,568 ml.
5. Stroncija hidroksīda šķīdība ūdenī 100 ° C temperatūrā ir 28 g, bet temperatūrā 25 ° C - 1 g uz 100 g ūdens. 200 g stroncija hidroksīda šķīduma, kas piesātināts 100 ° C temperatūrā, atdzesē līdz 25 ° C. Atrodiet stroncija hidroksīda oktahidrāta masu, kas izgulsnējas, kad šķīdums tika atdzesēts.
Atbilde. 93,08 g Sr (OH) 2 8H 2 O.
B līmenis
1. Noteiktu daudzumu kristāliska magnija karbonāta kalcinēja, līdz gāzes attīstība apstājās. Pēdējie tika izlaisti caur skalošanas pudelēm ar koncentrētu sērskābi un kaļķu ūdeni. Pirmās kolbas masa palielinājās par 1,8 g, otrajā - 2 g nogulsnes. Nosaka sākuma kristāliskā hidrāta sastāvu un tā masu.
Atbilde. MgCO 3 5H 2 O pentahidrāts; 3,48 g
2. Karbonāta, bikarbonāta un kalcija nitrāta molārā attiecība maisījumā, kas sver 100 g, ir 1: 2: 3 (uzskaitīšanas secībā). Kādu tilpumu pie 1200 ° C un normāla spiediena ņems šī maisījuma gāzveida sadalīšanās produkti?
Risinājums
Maisījuma sastāvdaļu sadalīšanās reakciju vienādojumi:
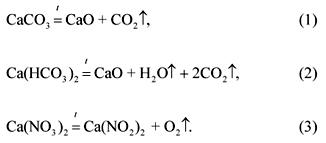
Pēc problēmas stāvokļa:
(CaCO 3): (Ca (HCO 3) 2): (Ca (NO 3) 2) \u003d 1: 2: 3.
Ļaujiet (CaCO 3) \u003d x kurmis.
Tad (Ca (HCO 3) 2) \u003d 2 x;
(Ca (NO 3) 2) \u003d 3 x;
100x + 162 2x +164 3x \u003d100,
x 0,109 mol.
Plkst lpp \u003d 101,3 kPa un t \u003d 1200 ° C gāzveida stāvoklī tas izdalās:
CO 2 saskaņā ar (1) vienādojumu:
1 (CO 2) \u003d (CaCO 3) \u003d x \u003d 0,109 mol;
H 2 O, CO 2 saskaņā ar vienādojumu (2):
2 (H 2 O) \u003d (Ca (HCO 3) 2) \u003d 2 x \u003d 0,218 mol,
2 (CO 2) \u003d 2 (Ca (HCO 3) 2) \u003d 4 x \u003d 0,436 mol;
O 2 saskaņā ar (3) vienādojumu:
3 (O 2) \u003d (Ca (NO 3) 2) \u003d 3 x \u003d 0,327 mol.
Kopējais gāzveida sadalīšanās produktu molu skaits:
0,109 + 0,218 + 0,436 + 0,327 \u003d 1,09 mol (n.a.).
No ideālo gāzu stāvokļa vienādojuma mēs atrodam tilpumu:
pV = RT,
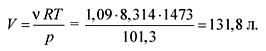
Atbilde. V \u003d 131,8 litri
3. Kalcinēja vienāda daudzuma divvērtīga metāla hidroksīda un karbonāta maisījumu. Cietā atlikuma masa izrādījās 1,775 reizes mazāka nekā sākotnējā maisījuma masa. Šim atlikumam pievienoja 10 reizes lielu masu 5% sērskābes šķīduma. Aprēķiniet iegūto šķīdumu vielu masas daļu.
Atbilde. 6% MgSO 4.
4. Ūdenim apstrādājot ar divvērtīga metāla hidrīda un nitrīda maisījumu ar vienādas masas frakcijām, izveidojās gāzes maisījums ar ūdeņraža blīvumu 2,658. Iestatiet savienojumos iekļauto metālu (aprēķinot, nevis noapaļojiet skaitļus!)
Atbilde. Kalcijs
5. 16 g magnija plātnes tika nomestas 16% vara (II) sulfāta šķīdumā, kas sver 350 g. Pēc plāksnes noņemšanas izrādījās, ka šķīdumā esošo sāļu masas daļas ir vienādas. Cik reizes palielināja plāksnes masu?
Atbilde. 4,5 reizes.
Kvalitātes uzdevumi
1. Kura no šīm vielām mijiedarbosies ar magnija hidroksīdu: sālsskābe, slāpekļskābe, oglekļa dioksīds, nātrija hlorīds, bārija hidroksīds, sērskābe, vara (II) oksīds?
Atbilde. HCl, HNO 3, H2SO4.
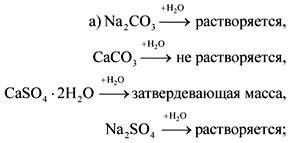
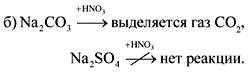
2. Pudeļās bez etiķetēm ir soda, krīts, ģipsis un nātrija sulfāts. Kā šīs vielas var atpazīt ar ūdeni un slāpekļskābi?
Atbilde.
3. Viela A ir viegls, diezgan ciets sudraba-balts metāls. Vielas A mijiedarbībā ar B, kas ir vienkārša gāzveida viela, veidojas savienojums C, kas šķīst ūdenī, veidojot sārmainu šķīdumu. Apstrādājot vielu ar sērskābi, veidojas sāls, kura kristālisko hidrātu medicīnā izmanto fiksējošo pārsēju uzlikšanai lūzumiem. Sniedziet reakcijas vienādojumus.
Atbilde. A ir Ca; B ir H2; C ir CaH2; kristālisks hidrāts - CaSO 4 2H 2 O.
4. Viela A ir ūdenī šķīstošs oksīds, veidojot sārmainu šķīdumu. Šajā šķīdumā esošais savienojums B reaģē ar gāzi C bez smaržas, veidojot baltas nogulsnes, kuras pakāpeniski izšķīst, pārejot gāzei C. Norādiet reakcijas vienādojumus un identificējiet vielas.
Atbilde. A ir CaO, BaO; B ir Ca (OH) 2, Ba (OH) 2; C ir CO 2.
5. Viela A, kas ir daļa no viena no visbiežāk sastopamajām minerālām zemes garozā, augstā temperatūrā sadalās divos oksīdos, no kuriem viens dzīvības procesā vienmēr veidojas. Kad viela B mijiedarbojas ar grafītu, to karsējot, gāze C, kas ir toksiska siltasiņu dzīvniekiem, ir viegli uzliesmojoša, bezkrāsaina un bez smaržas. Sniedziet reakciju vienādojumus, identificējiet vielas.
Atbilde. A - CaCO3; B ir CO2; C - CO.
Ūdens cietība un tās novēršana
Ķīmijas kopsavilkums
Tēma:“Ūdens cietība”
Darbuzņēmējs:Grabins Pāvels.
Plāns
Ievads 3
Ūdens cietības noteikšana. 3
Stiprināšanas paņēmieni 4
Atsauces 6
Ievads
Alās kaveri sastopas ar skaistākajiem kaļķakmens veidojumiem - stalaktītiem, kas karājas no arkām, un stalagmītiem, kas aug uz augšu. No ķīmijas viedokļa šo apbrīnojamo dabas darbu parādīšanās ir gruntsūdeņu stingrība. Mēs sastopamies ar ūdens cietības jēdzienu ne tikai speleoloģijā un ģeoloģijā, bet kopumā visur - ķīmijā, tehnoloģijās un pat ikdienā. Un tāpēc šī koncepcija ir ļoti svarīga, lai noteiktu ūdens kvalitāti.
Ūdens cietības noteikšana
Ūdens cietība - ūdens īpašība (to nedrīkst mazgāt, lai tvaika katlos iegūtu skalu), kas saistīta ar tajā šķīstošā kalcija un magnija savienojumu saturu, tas ir parametrs, kas parāda kalcija un magnija katjonu saturu ūdenī.
Cietība ir ūdens īpašās īpašības, kas lielā mērā nosaka tā patērētāja īpašības un tāpēc tai ir svarīga ekonomiskā vērtība. Cietais ūdens veido katlakmens, bateriju utt. Sienas, kas ievērojami pasliktina to siltumietilpību. Šāds plāns slānis uz sildīšanas virsmas nepavisam nav nekaitīgs, jo sildīšanas ilgums caur mērogojošu slāni, kam ir zema siltumvadītspēja, pakāpeniski palielinās, dibens izdeg ātrāk un ātrāk - galu galā metāls katru reizi lēnāk un lēnāk atdziest, tas ilgstoši paliek uzkarsētā stāvoklī. Galu galā var gadīties, ka kuģa dibens neizturēs un ļaus noplūst. Šis fakts ir ļoti bīstams rūpniecībā, kur pastāv tvaika katli.
Cietais ūdens nav piemērots mazgāšanai. Ja veļas mazgājamo mašīnu sildītāji samazina to sakārtotību, tas pasliktina arī ziepju mazgāšanas īpašības. Ca 2+ un Mg 2+ katjoni reaģē ar ziepju taukskābēm, veidojot slikti šķīstošus sāļus, kas veido plēves un nogulsnes, galu galā samazinot mazgāšanas kvalitāti un palielinot mazgāšanas līdzekļa patēriņu, t.i. slikti ir cietā ūdens slīpmašīnas
Pastāv divu veidu stīvums: īslaicīgs un pastāvīgs. Šī atšķirība ir saistīta ar anjonu veidu, kas atrodas šķīdumā kā pretsvars kalcijam un magnijam.
Pagaidu cietība kas saistīti ar hidrokarbonāta vai bikarbonāta anjonu (HCO 3 -) klātbūtni ūdenī kopā ar Ca 2+, Mg 2+ un Fe 2+ katjoniem.
Pastāvīga stingrība (vai bez karbonāta) rodas, ja šķīdumā ir sulfāti, hlorīdi, nitrāti un citi anjoni, kuru kalcija un magnija sāļi labi šķīst un tāpēc tos vienkārši nevar noņemt. Kopējā cietība tiek definēta kā visu kalcija un magnija sāļu kopējais saturs šķīdumā.
Dažādām valstīm ir savi ūdens cietības standarti. Mūsu valstī ūdens tiek klasificēts pēc cietības šādā veidā:
Mīksts ūdens ar cietību mazāku par 3,0 mEq / l,
Vidēja cietība 3,0-6,0 mEq / L
Ciets - vairāk nekā 6,0 mEq / ml.
Stingrības novēršanas metodes.
Lai atbrīvotos no īslaicīgas cietības, jums vienkārši nepieciešams vārīt ūdeni. Verdošā ūdenī bikarbonātu anjoni reaģē ar katjoniem un ar tiem veido ļoti slikti šķīstošus karbonātu sāļus, kas izgulsnējas.
Ca 2 + 2HCO 3 - \u003d CaCO 3 ↓ + H 2 O + CO 2
Ar dzelzs joniem reakcija ir sarežģītāka sakarā ar to, ka FeCO 3 ir nestabila viela ūdenī. Skābekļa klātbūtnē reakcijas ķēdes gala produkts ir Fe (OH) 3, kas ir tumši sarkanas nogulsnes. Tāpēc, jo vairāk dzelzs ir ūdenī, jo spēcīgāka krāsa ir mērogā, kas vārīšanās laikā nogulst uz trauka sienām un dibena.
Ar pastāvīgu stīvumu ir grūtāk cīnīties. Viena iespēja: ledus sasalšana. Jums vienkārši nepieciešams pakāpeniski iesaldēt ūdeni. Kad paliek aptuveni 10% šķidruma no sākotnējā daudzuma, ir nepieciešams novadīt nesasaldēto ūdeni un pārvērst ledu atpakaļ ūdenī. Visi sāļi, kas veido cietību, paliek nesasaldētā ūdenī.
Pārtika ir viens veids - destilācija, tas ir, ūdens iztvaikošana ar sekojošu kondensāciju. Tā kā sāļi ir gaistoši savienojumi, tie paliek, un ūdens iztvaiko.
Bet tādas metodes kā sasaldēšana un destilācija ir piemērotas tikai neliela ūdens daudzuma mīkstināšanai. Rūpniecība nodarbojas ar tonnām. Tāpēc tiek izmantotas citas metodes. Visplašāk izmantotā katjonu apmaiņas metode, kuras pamatā ir īpašu reaģentu - katjonu apmaiņas līdzekļu izmantošana, kas tiek ievietoti filtros un, caur tiem izlaižot ūdeni, kalcija un magnija katjonus aizstāj ar nātrija katjoniem.
Ūdens masas cietības dēļ no ķīmijas viedokļa jūs varat cīnīties ļoti viegli. Ir nepieciešams ietekmēt vājās skābes sāli ar stiprāku skābi. Pēdējais aizstāj ogles, kuras, būdamas nestabilas, sadalās ūdenī un oglekļa dioksīdā. Masas sastāvs var ietvert silikāti, kā arī sulfāti un fosfāti. Bet, ja jūs iznīcināt karbonāta "skeletu", tad šie savienojumi nepaliks uz virsmas.
Kā atkaļķošanas līdzekļus izmanto arī adipīnskābi un maleīnskābes anhidrīdu, ko pievieno ūdenim. Šīs vielas ir vājākas nekā sulfamīnskābe, tāpēc katlakmens noņemšanai ir nepieciešama arī vārīšana.
Atsauces:
Shpausus Z. Ceļojumi uz ķīmijas pasauli - Maskava: Izglītība, 1967. - 431. gads.
Kharlampovičs G.D. un citi.Daudzpusīga ķīmija. - M .: Izglītība, 1992.-159 lpp.
Homčenko G.P. Ķīmijas mācību grāmata –M .: Jaunais vilnis, 1996. - 304 lpp.
Līdzīgas esejas:
Poliarilātu atšķaidītu šķīdumu īpašību izpēte, ņemot vērā divus faktorus: makromolekulu konformāciju šķīdumā un šķīdinātāju molekulu orientāciju secībā, kas tās izšķīdina, kas tika vērtēts pēc šķīduma termodinamiskajiem parametriem un struktūras.
Pirmā un otrā posma paralēli precīzu jonīta filtru mērķis un struktūra, jaukta darbība. Pretplūsmas jonizācijas tehnoloģijas raksturojums. Ūdens mīkstināšanas nātrija katjonu metodes apraksts. Ūdens atsāļošanas un atsāļošanas principi.
Katjonu apmainītāji un to īpašības. Ūdens mīkstināšanas process ar nātrija katjonu. Ūdeņu mīkstinātājs ar ūdeņraža un nātrija katjonu apmaiņu. Kalckatīta un daļējas katjonizācijas metodes. Katjonu apmaiņas filtri un katjonu apmaiņas iekārtu palīgierīces.
Kas ir putas un virsmaktīvās vielas. Virsmas spraigums kā fāzes saskarnes vissvarīgākais raksturlielums. Ūdens cietības ietekmes uz putošanu un putu stabilitāti dažāda veida virsmaktīvajām vielām eksperimentālo pētījumu metodes.
Ūdens īpašības un tā mīkstināšanas metodes. Prasības patērētā ūdens cietībai siltuma un enerģijas nozarē. Teorētiskie pamati un metodes ūdens cietības noteikšanai, izmantojot kompleksometrisko metodi. Paraugu ņemšana, reaģenti, noteikšana.
Oglekļa iegūšana koksnes termiskās sadalīšanās ceļā, izšķīdušo vielu un gāzu absorbcija oglēs. Oglekļa dioksīda mijiedarbība ar sārmu, oglekļa monoksīda veidošanās un tā īpašību izpēte. Iepazīšanās ar karbonātu un bikarbonātu īpašībām.
Dzeramā ūdens kvalitātes nosacīti rādītāji. Organisko vielu noteikšana ūdenī, varā un svina jonos. Ūdens cietības novēršanas metodes. Ūdens tīrīšanas veidi. Kālija sulfāta darba šķīduma pagatavošana. Ūdens attīrīšana ar daļēju sasaldēšanu.
Kalcija ķīmiskās īpašības. Tīra kalcija karbonāta izmantošana optikā, kaļķakmens metalurģijā - kā plūsmas. Ģipsis kā kalcija sulfāta kristāliskais hidrāts. Fosforskābes kalcija sāls kā galvenā fosforītu un apatītu sastāvdaļa.
Oglekļa savienojumu daudzveidība, to izplatība dabā un pielietojums. Allotropās modifikācijas. Brīvā oglekļa atoma fizikālās īpašības un struktūra. Oglekļa ķīmiskās īpašības. Karbonāti un bikarbonāti. Dimanta un grafīta struktūra.
Litosfēras raksturojums, ķīmisko elementu un minerālu sastāvs zemes garozā. Hidrosfēras struktūra, ķīmiskais sastāvs un funkcijas, atmosfēra. Biosfērā notiekošo organisko vielu fotosintēzes pazīmes. Bioģeoķīmisko procesu izpēte.
Augsta ūdens cietība apkures un karstā ūdens sistēmās negatīvi ietekmē siltuma pārneses procesus, palielinot enerģijas patēriņu. Turklāt cietais dzeramais ūdens ir kaitīgs cilvēku veselībai. Ūdenim dažādiem mērķiem tiek izmantotas dažādas mīkstināšanas metodes.
Ūdens mīkstināšana ir cietības sāļu noņemšanas process no ūdens. Bet kas ir ūdens cietība un kāpēc to vajadzētu noņemt?
Ūdens cietības jēdziens parasti tiek saistīts ar kalcija (Ca 2+) un mazākā mērā ar magnija (Mg 2+) katjoniem. Faktiski visi divvērtīgie katjoni vienā vai otrā pakāpē ietekmē stīvumu. Tie mijiedarbojas ar anjoniem, veidojot savienojumus (cietības sāļus), kas var izgulsnēties.
Dzelzs, mangāna un stroncija sāļi var arī izgulsnēties, taču praksē visiem šiem elementiem ir tik maza ietekme uz stīvumu, ka tos parasti atstāj novārtā.
Alumīnijs (Al 3+) un dzelzs dzelzs (Fe 3+) ietekmē arī cietību, bet dabiskajos ūdeņos pie pH līmeņa to šķīdība un attiecīgi “ieguldījums” cietībā ir niecīgs. Tāpat netiek ņemts vērā bārija (Ba 2+) nenozīmīgais efekts.
Stīvuma veidi
Ir vairāki ūdens cietības veidi. Kopējo cietību nosaka kopējā kalcija un magnija jonu koncentrācija. Tā ir karbonāta (īslaicīga) un bezkarbonāta (pastāvīga) stinguma summa.
Karbonāta cietība ir saistīta ar hidrokarbonātu un karbonātu klātbūtni ūdenī (pie pH\u003e 8,3). Pagaidu cietībai raksturīga klātbūtne ūdenī kopā ar hidrokarbonāta katjoniem Ca 2+, Mg 2+ un Fe 2+ vai bikarbonātu anjoniem (HCO 3-). Šāda veida cietību gandrīz pilnībā novērš verdošs ūdens, un tāpēc to sauc par pagaidu cietību. Sildot ūdeni, ogļūdeņraži sadalās, veidojot ogļskābi un nogulsnējot kalcija karbonātu, magnija hidroksīdu un dzelzi.
Neskarbonātu cietība ir saistīta ar stipru skābju (sērskābes, slāpekļa, sālsskābes) kalcija un magnija sāļu klātbūtni, un to neizdala vārot, tāpēc tā ir saņēmusi pastāvīgas cietības nosaukumu.
Vienības
Pasaules praksē tiek izmantotas vairākas stingruma vienības, un tās visas zināmā mērā ir savstarpēji saistītas.
Cietības vienību uzskata par ūdens cietību, kura 1 litrā ir 1 mmol Ca 2+ vai Mg 2+ ekvivalentu. Viena cietības vienība (1 mmol / L) atbilst kalcija jonu saturam, kas vienāds ar 20,04 mg / L, vai magnija jonu saturam, kas vienāds ar 12,15 mg / L. Ūdens kopējo cietību (H) var aprēķināt pēc formulas:
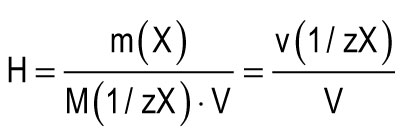
m (X) ir izšķīdušās vielas masa, mg; M (1 / zX) ir vielas ekvivalenta molārā masa, mg / mmol (g / mol); V ir ūdens tilpums, l; M (1 / zCa2+) \u003d 20,04 mg / mmol; M (1 / zMg 2+) \u003d 12,15 mg / mmol.
Turklāt ārvalstīs plaši izmanto tādas stingruma vienības kā Vācijas grāds (˚d, dH), Francijas grāds (˚f), Amerikas grāds un ppm CaCO 3.
Šo stingruma vienību attiecība ir parādīta tabulā. 1.
1. tabula. Dažādu stingruma vienību attiecība
Tātad viens vācu grāds ūdenī atbilst 10 mg / dm 3 CaO vai 17,86 mg / dm 3 CaCO 3. Viena Francijas grāds ir 10 mg / dm 3 CaCO 3 ūdenī, un Amerikas grāds ir līdzvērtīgs 1 mg / dm 3 CaCO 3 ūdenī.
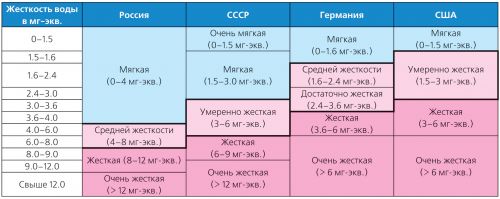
Ūdens cietība ir ļoti atšķirīga, un ir daudz veidu klasifikāciju. Tātad Vācijā tiek piemēroti Vācijas Standartizācijas institūta (DIN 19643) stingrības standarti, bet ASV - klasifikācija, kuru 1986. gadā pieņēma Vides aizsardzības aģentūra (USEPA) (2. tabula).
2. tabula. Dažādu veidu stingruma klasifikācija
Kurš ūdens ir mīkstāks
Parasti zemas mineralizācijas ūdeņos cietība pārsvarā ir kalcija jonu dēļ (lai arī dažos retos gadījumos magnija cietība var sasniegt 50–60%). Palielinoties vispārējās ūdens mineralizācijas pakāpei, kalcija jonu (Ca 2+) saturs strauji samazinās un reti pārsniedz 1 g / l. Magnija jonu (Mg 2+) saturs stipri mineralizētajos ūdeņos var sasniegt vairākus gramus, bet sāls ezeros - desmitiem gramu uz litru ūdens.
Kopumā virszemes ūdens cietība parasti ir mazāka nekā gruntsūdeņu cietība. Virszemes ūdens cietība ir pakļauta ievērojamām sezonālām svārstībām, parasti tā lielāko vērtību sasniedz ziemas beigās un zemāko plūdu laikā, kad to bagātīgi atšķaida ar mīkstu lietu un kausētu ūdeni. Jūras un okeāna ūdenim ir ļoti augsta cietība (desmitiem un simtiem meq / l).
Stīvuma sekas
Cietais dzeramais ūdens ir rūgts magnija garšas dēļ, un tas negatīvi ietekmē gremošanas sistēmu. Saskaņā ar Pasaules Veselības organizācijas (PVO) standartiem optimālā dzeramā ūdens cietība ir 1,0–2,0 mEq / l.
Pārtikas produkti ir slikti sagremoti cietajā ūdenī, jo kalcija katjoni ar pārtikas olbaltumvielām veido nešķīstošus savienojumus; viņu uzturvērtība ir samazināta. Pastāvīga cieta ūdens lietošana var izraisīt sāļu (urolitiāzes) nogulsnēšanos cilvēka ķermenī.
Tēja un kafija šādā ūdenī ir vāji pagatavota. Sadzīves apstākļos pārmērīgas cietības sāļu dēļ apkures katli, tējkannas, caurules tiek sildīti virsmām, sāļi tiek nogulsnēti uz santehnikas armatūrā un to bojājumi atstāj nogulsnes uz cilvēka matiem un ādas, radot nepatīkamu viņu “cietības” sajūtu.
Ūdens cietība, kas tiek izmantota dažādu produktu pagatavošanai, ir skaidri regulēta un ir 0,1–0,2 mekv / l līmenī.
Cietais ūdens veido katlakmens, akumulatora utt. Sienas, kas ievērojami pasliktina to siltumietilpību, un samazina cauruļvadu brīvo daļu.
Cauruļvadi ir aizauguši ar mēroga nogulsnēm tik daudz, ka to produktivitāte vairākas reizes pazeminās. Tāpēc tajos procesos, kur pieļaujama ūdens lietošana ar noteiktu sāls saturu, tā stingrība tiek ierobežota līdz vēl zemākām vērtībām - 0,03–0,05 mEq / l.
Ja veļas mazgājamo mašīnu sildītāji samazina to kvalitāti. Mazgājot, mijiedarbojoties ar ziepju vai veļas mazgāšanas līdzekļu aktīvajām vielām (virsmaktīvajām vielām), cietības sāļi tās saista un prasa lielāku patēriņu. Cietais ūdens nav izmantojams, veicot noteiktus tehnoloģiskos procesus, piemēram, krāsošanas laikā, elektroķīmijā utt.
Sāls noņemšana
Ca 2+ un Mg 2+ sāļu ekstrakcijas procesus ūdenī ūdens attīrīšanā sauc par ūdens mīkstināšanu.
Salīdzinoši selektīvu cietības sāļu noņemšanu no ūdens var veikt ar šādām metodēm:
- termiskā apstrāde;
- destilācija;
- reaģenta mīkstināšana;
- sasalšana;
- magnētiskā apstrāde;
- ultraskaņas apstrāde;
- jonu apmaiņa;
- apgrieztā osmoze.
Ir zināmas arī ūdens apstrādes metodes (elektromagnētiskā iedarbība, polifosfātu vai citu “anti-skalas” pievienošana), kas ļauj uz brīdi “saistīt” cietības sāļus, neļaujot tiem kādu laiku izkrist mēroga formā. Tomēr šīs metodes ķīmiski neitralizē cietības sāļus, tos faktiski nenoņem, un tāpēc to izmantošana rūpnieciskā ūdens attīrīšanā ir ierobežota.
Termiskā mīkstināšana
Tādā veidā viņi atbrīvojas no īslaicīga stīvuma, ko izraisa kalcija un magnija bikarbonāti. Verdošā ūdenī ogļūdeņraži sadalās, veidojot vidēja vai bāzes karbonāta nogulsnes:
Ca (HCO 3) 2 \u003d CaCO 3 ↓ + CO 2 + H 2 O,
Mg (HCO 3) 2 \u003d Mg 2 (OH) 2 CO 3 ↓ + 3CO 2 + H 2 O.
Tā rezultātā samazinās ūdens cietība. Tāpēc bikarbonāta stīvumu sauc par īslaicīgu.
Ar dzelzs joniem reakcija ir sarežģītāka sakarā ar to, ka FeCO 3 ir nestabila viela ūdenī. Skābekļa klātbūtnē reakcijas ķēdes gala produkts ir Fe (OH) 3, kas ir tumši sarkanas nogulsnes. Tāpēc, jo vairāk dzelzs ir ūdenī, jo spēcīgāka krāsa ir mērogā, kas vārīšanās laikā nogulst uz trauka sienām un dibena.
Tādējādi, vārot ūdeni ikdienas dzīvē, vienlaikus notiek tā daļējas mīkstināšanas process.
Destilācija
Destilācija ir tradicionāla, efektīva un uzticama metode, kas nodrošina ļoti sāļa ūdens ar augstu sāļumu un cietību augstu attīrīšanas pakāpi.
Ūdens iegūšanas ar šo metodi vispārējais princips ir šāds: iepriekš sagatavots dzeramais ūdens nonāk destilētājā, kas sastāv no trim galvenajām sastāvdaļām: iztvaicētāja, kondensatora un kolektora.
Iztvaicētājs ar ūdeni tiek uzkarsēts līdz vārīšanās temperatūrai. Ūdens tvaiki nonāk kondensatorā, kur tie tiek sašķidrināti un destilāta veidā nonāk kolektorā. Visi negaistošie piemaisījumi, kas atrodas avota ūdenī, paliek destilētājā.
Lai iegūtu attīrītu ūdeni, tiek izmantoti destilētāji, kas atšķiras viens no otra sildīšanas, produktivitātes un dizaina īpašību ziņā.
Vienreizējās destilācijas metode ir neekonomiska, jo, kad to izmanto, ir augstas enerģijas izmaksas apkurei un iztvaikošanai (apmēram 3000 kJ uz 1 kg tvaika), kā arī ūdens patēriņš tvaika kondensācijai (apmēram 8 litri ūdens 1 kg tvaika). Tāpēc zemam ūdens patēriņam - 10-20 l / h - ieteicams izmantot vienu destilāciju.
Efektīvāki un ekonomiskāki par parasto destilāciju ir augstas veiktspējas daudzkolonu destilētāji. Bet tie ir ārkārtīgi dārgi, turklāt ūdens sagatavošanas izmaksas viņiem ir augstas.
Ir vērts atzīmēt, ka destilācijas metode noņem visus izšķīdušos sāļus avota ūdenī.
Reaģenta pielietojums
Ir ūdens mīkstināšana ar kaļķošanu, sodas kaļķošanu un sodas-nātrija metodi ūdens mīkstināšanai.
Kaļķojot, šķīdumam pievieno hidratētu kaļķi Ca (OH) 2 līdz pH apmēram 10. Rezultātā notiek reakcija:
Ca (HCO 3) 2 + Ca (OH) 2 \u003d 2 CaCO 3 + 2H 2 O,
Mg (HCO 3) 2 + 2Ca (OH) 2 \u003d Mg (OH) 2 + 2СaCO 3 + 2Н 2 O.
Šo metodi izmanto ūdens ar augstu karbonātu un zemu bezkarbonātu cietības pakāpi, kad nepieciešama vienlaicīga cietības un sārmainības samazināšanās. Atlikušā stīvums ir par 0,4-0,8 mEq / L lielāks nekā bezkarbonāta stingums.
Pievienojot sodas kaļķus, ūdenim tiek pievienota novājēta kaļķis Ca (OH) 2 un soda Na 2 CO 3 līdz pH apmēram 10. Rezultātā notiek šādas reakcijas:
Ca (HCO 3) 2 + Ca (OH) 2 + Na 2 CO 3 \u003d 2 CaCO 3 + 2NaOH + H 2 CO 3,
Mg (HCO3) 2 + 2NaOH \u003d Mg (OH) 2 + 2NaHCO3.
Kā izriet no reakcijas vienādojumiem, nogulumu veidošanās un sedimentācijas procesā no ūdens tiek iegūti cietības sāļi. Kopā ar tiem tiek noņemtas koloidālās un suspendētās daļiņas ar saistīto piesārņojumu. Organiskās nogulsnes daļēji tiek sorbētas uz nogulšņu pārslām.
Ar sodas kaļķošanu HCO 3 jonu pārsnieguma dēļ tiek panākta lielāka cietības sāļu noņemšana no ūdens. Temperatūras paaugstināšana līdz 70–80 ° C ļauj atlikušo stīvumu samazināt līdz 0,35–1,0 mEq / L. To pašu rezultātu var sasniegt, palielinot reaģentu devas.
Sodas soda metode
Sodas pievienošana ir nepieciešama, ja nekarbonātu cietība ir lielāka par karbonātu. Ja šie parametri ir vienādi, sodas pievienošana var nebūt vajadzīga.
Kalcija un magnija ogļūdeņraži, reaģējot ar sārmiem, veido slikti šķīstošus kalcija un magnija, sodas, ūdens un oglekļa dioksīda savienojumus:
Ca (HCO 3) 2 + 2NaOH \u003d CaCO 3 ↓ + Na 2 CO 3 + 2H 2 O,
Mg (HCO 3) 2 + 2NaOH \u003d Mg (OH) 2 ↓ + Na 2 CO 3 + H 2 O + CO 2.
Oglekļa dioksīds, kas rodas magnija hidrogēnkarbonāta reakcijas rezultātā ar sārmu, atkal reaģē ar sārmu, veidojot sodas un ūdeni:
CO 2 + NaOH \u003d Na 2 CO 3 + H 2 O.
Cietība bez karbonāta
Sulfāts un kalcija hlorīds reaģē ar soda, kas veidojas karbonātu cietības un sārma reakcijās, un pievienojot sodas, veidojot kalcija karbonātu, kas nepiesaistās sārmainā stāvoklī:
CaCl 2 + Na 2 CO 3 \u003d CaCO 3 ↓ + 2NaCl,
CaSO 4 + Na 2 CO 3 \u003d CaCO 3 ↓ + Na 2 SO 4.
Magnija sulfāts un hlorīds reaģē ar sārmu, veidojot nogulsnētu magnija hidroksīdu:
MgSO4 + 2NaOH \u003d Mg (OH) 2 ↓ + Na2SO4,
MgCl2 + 2NaOH \u003d Mg (OH) 2 ↓ + 2NaCl.
Sakarā ar to, ka bikarbonāta reakcijā ar sārmu veidojas soda, kas pēc tam reaģē ar cietību, kas nav karbonāts, tās daudzumam jābūt korelētam ar karbonāta (LFA) un bezkarbonāta (LFA) cietības attiecību:
- ja tie ir vienādi, soda var izlaist;
- ar nosacījumu Lc\u003e Lnc veidojas sodas pārpalikums;
- ar LCD attiecību< Жнк - недостаток соды и ее необходимо добавлять.
Nosēdināšanas procesus veic sedimentācijas tvertnēs un dzidrinātājos ar suspendētu nogulumu slāni.
Sedimentācijas tvertnes ir neefektīvas, un tajās iegūtajā hidroksīda celulozes mitrums ir augsts - 97-99%. Tāpēc pašlaik tie praktiski netiek izmantoti.
Praksē tiek izmantotas dažādas dzidrinātāju versijas ar suspendētu nogulumu slāni. Tajos attīrošais šķīdums tiek piegādāts no apakšas un iziet cauri nogulumu slānim. Tas palielina ūdens attīrīšanas koeficientu.
Dzeramā ūdens sagatavošanā neizmanto reaģentu metodes. Pēc tām ūdenim ir izteikti sārmaina reakcija. Tāpēc reaģentus plaši izmanto enerģētikā un rūpniecībā kā mehānisko filtru attīrīšanas pirmo posmu. Strādājot kopā, tie ļauj mīkstināt ūdeni, noņem suspendētās cietās vielas, ieskaitot koloīdus, un daļēji attīra ūdeni no organiskām vielām.
Sasalšana
Lai cīnītos ar pastāvīgu ūdens cietību, tiek izmantota tāda metode kā ledus sasalšana. Lai to izdarītu, jums vienkārši nepieciešams pakāpeniski iesaldēt ūdeni. Kad apmēram 10% šķidruma paliek no sākotnējā daudzuma, ir nepieciešams novadīt nesasaldēto ūdeni un pārvērst ledu atpakaļ ūdenī. Visi sāļi, kas veido cietību, paliek nesasaldētā ūdenī.
Vienlaicīgi ar destilāciju tas ir arī viens no veidiem, kā atsālīt ļoti sāļu ūdeni līdz dzeramajai kvalitātei.
Citas metodes
Elektrodialīzes metode ir balstīta uz elektrolītu jonu virzītas kustības fenomeniem, kas savienoti ar līdzstrāvas tīklu. Tādējādi metāla joni, kas nosaka ūdens cietību, tiek ieslodzīti pie elektrodiem un tiek atdalīti no ūdens, atstājot ūdens apstrādes aparātu.
Magnētiskās jonizācijas metode izmanto arī jonu virzītas kustības fenomenu, bet jau magnētiskā lauka ietekmē. Lai palielinātu jonu skaitu ūdenī, to sākotnēji apstaro ar jonizējošo starojumu.
Ūdens magnētiskā apstrāde sastāv no ūdens izlaišanas caur pretēju virzienu magnētisko lauku sistēmu. Tā rezultātā samazinās izšķīdušo vielu hidratācijas pakāpe un to apvienojums lielākās daļiņās, kas izgulsnējas.
Ūdens apstrāde ar ultraskaņu noved pie arī lielāku izšķīdušo vielu daļiņu veidošanās ar nogulumu veidošanos.
Jonu apmaiņas metodi un reversās osmozes procesus ieteicams detalizēti apsvērt raksta otrajā daļā, kuru mēs publicēsim mūsu žurnālā nākamajā numurā.
