Ngurtësia e ujit dhe eleminimi i tij. Detyrat dhe ushtrimet për metale të nëngrupit të iA
Faqe 1
Eleminimi i ngurtësisë së përkohshme kryhet me ujë të valë. Pas zierjes, hidrokarburet janë shkatërruar, dhe karbonatet e tretshme dobët të formuara precipitojnë. Kur karbonat natriumi, hidroksidi i kalciumit futet në ujë, ngurtësia totale e ujit hiqet. Në këtë rast, ngurtësia e karbonatit eliminohet nga gëlqerja, dhe ngurtësia jo karbonat eliminohet nga sode.
Përveç eliminimit të ngurtësisë së përkohshme, gëlqereja precipiton të gjithë magnezin dhe hekurin nga uji dhe promovon koagulimin e koloideve organike dhe inorganike.
Pas pastrimit të papastërtive, duke eleminuar ngurtësinë dhe deaeracionin e përkohshëm, uji make-up futet në shkëmbyesin e nxehtësisë (2), ku nxehet në 335 K. Pas përzierjes, uji i përbërjes dhe kthimit pompohet në zonën e dytë të shkëmbyesit të nxehtësisë (2), ku nxehet në 355 K dhe derdhet në rrjetet e ngrohjes.
Zbutja shpesh përdoret për të eleminuar ngurtësinë e përkohshme të ujit, e krijuar për të kompensuar humbjet (rimbushjen) në sistemet e furnizimit me ujë të qarkulluar të mbyllur dhe për të parandaluar grumbullimin mineral të sipërfaqeve të shkëmbyesit dhe ftohjes në kontakt me ujin qarkullues. Në shumë raste, uji make-up është burimi kryesor i akumulimit të joneve të kalciumit dhe biokarbonateve në ujin qarkullues, i cili në sistemet me koeficientë të lartë avullimi mund të prishin përbërjen e qëndrueshme të ujit qarkullues.
Zbutja e ujit për të eleminuar ngurtësinë e përkohshme kryhet kimikisht duke futur reagentë, të cilët përdoren si gëlqere, acid sulfurik ose klorhidrik. Metodat kimike arrijnë në zbutjen e ujit relativisht të cekët. Për një shkallë më të lartë zbutjeje, përdoren metoda të shkëmbimit të kationit, thelbi i të cilave është përdorimi i aftësisë së substancave të caktuara për të shkëmbyer katione të natriumit që përmbahen në to për katione të kripërave të ngurtësisë në ujë.
Sode kaustike përdoret në termocentrale për të eleminuar ngurtësinë e përkohshme të ujit, për rigjenerimin e filtrave anovitikë që përdoren në bimë për desalination kimike të ujit.
Sode kaustike përdoret në termocentralet termocentrale për të eleminuar ngurtësinë e përkohshme të ujit dhe për të rigjeneruar filtrat anionikë të përdorur në impiantet e desalination kimike.
Në mënyrë të ngjashme, sasia e Ca (OH) 2 e nevojshme për të eleminuar ngurtësinë e përkohshme gjithashtu duhet të llogaritet.
Pse, për të eleminuar ngurtësinë e përkohshme për shkak të kripërave të magnezit, kërkohet më shumë gëlqere sesa të eleminohet ngurtësia e përkohshme për shkak të kripërave të kalciumit.
Prandaj, për të rimbushur sistemet e furnizimit me ujë të mbyllur (pa pastrim), duhet të bëhet një zbutje relativisht e thellë e ujit të make-up dhe eliminimit të ngurtësisë së përkohshme.
Futja e sasive të vogla të reagentëve alkaline rrit efikasitetin e trajtimit magnetik të ujit, megjithëse futja e reagentëve alkaline, për shembull, gëlqere në sasi jo më shumë se 10 - - 20% të atyre që janë të nevojshme për të eleminuar ngurtësinë e përkohshme, sipas studimeve të kryera në KhIEI në 1959, zvogëlon formimin e shkallës 8 deri 10 herë.
Në këtë rast, uji me gjashtë kocka të shkaktuara nga bikarbonate eliminohet. Prandaj, kjo ngurtësi quhet e përkohshme, ose bikarbonate. Prandaj, për të eleminuar ngurtësinë e përkohshme, mjafton të vloni ujë.
Kripërat e ngurtësisë së vazhdueshme, për shembull, CaCl, CaSO4, etj., Nuk hiqen nga uji kur nxehen. Ato janë precipituar gjatë avullimit të ujit, duke formuar në muret e aparatit të vështirë për tu hequr në shkallë të dendur. Uji i fortë mund të përdoret vetëm në rastet kur kushtet e përdorimit të tij nuk shkaktojnë reshje të sedimenteve të ngurta, për shembull, në frigoriferë ku uji ftohës nuk nxehet deri në një temperaturë që ndihmon në eliminimin e ngurtësisë së përkohshme. Në bimët e bojlerit, ku uji jo vetëm që nxehet, por edhe avullon, jo vetëm që është i përkohshëm, por edhe ngurtësia e vazhdueshme është e papranueshme. Prandaj, uji për ta pastrohet paraprakisht nga kripërat e kalciumit dhe magnezit me një metodë kimike në bimë të veçanta.
Institucion arsimor komunal
"Shkolla e mesme numër 1
me studim të thelluar të lëndëve individuale
Adresa: Qarku Belgorod,
Test i ngurtësisë së ujit
dhe mënyrat për ta eleminuar atë
studenti 11 Mesatarja e klasës "A" MOU "
shkolla e mesme numër 1
me studim të thelluar
sendet individuale
Adresa: Qarku Belgorod,
Këshilltar shkencor :,
mësues kimie
shkolla e mesme numër 1
me studim të thelluar
sendet individuale
novy Oskol, Rajoni i Belgorod
Adresa: Qarku Belgorod,
novy Oskol,
novy Oskol
1. Hyrje ………………………………………………………………………………… .3
2. Ngurtësia e ujit dhe metodat për eleminimin e tij ………………………………… .4
· Pse uji bëhet i vështirë .............................................................. 4
· Vlera e ngurtësisë së ujit në jetën e njeriut ...................................... 4
· Mënyrat për të eleminuar ngurtësinë …………………………………………………… 5
3. Studimi i ngurtësisë së ujit dhe metodave për eliminimin e tij .............. ... 8
4. Përfundime dhe përfundime
5. Lista e referencave
paraqitje
Kush studioi shkencat, por nuk i zbaton ato,
i ngjashëm me atë që ka lëruar, por nuk mbjell.
Saadi
Në vitet 80 të shekullit të 20-të, librat e Paul Chappius Bragg u shfaqën për promovimin e një jetese të shëndetshme. Dhe, megjithëse shumë studiues e konsiderojnë mendimin e tij të diskutueshëm, librat e Paul Bragg meritojnë vëmendje. Një nga pjesët e librit të tij (Eksperimentet e mia të para me ngurtësi) i kushtohet problemit të ngurtësisë së ujit, ku autori në kujtimet e tij përshkruan sëmundjen e gjyshit të tij, i cili vdiq nga fakti se enët e tij të gjakut u bë petifikimi nga uji i fortë, dhe gruaja që jetonte në pjesët e tyre ( gruaja fatkeqe quhej grua guri, pasi trupi i saj u petifikua fjalë për fjalë nga një numër i madh kripërash). Ajo grua ishte një nga viktimat e shumta të ujit të fortë. Organet fatkeqe nuk arritën të përballojnë përpunimin e një sasie të madhe të substancave inorganike të përmbajtura në ujë të tillë, dhe ata filluan të grumbullohen shumë në mënyrë aktive në trupin e saj.
Komponimet e kalciumit precipitojnë në trupin tonë në formën e gurëve në veshka dhe fshikëzës së tëmthit.
Sot, trajtimi i ujit nuk është një çuditje dhe përkëdhelje, por më tepër një domosdoshmëri jetësore. Fakti është se fenomene të tilla të pakëndshme si zhumba, tymosje të palëve të treta, erë, si dhe prania e një reshje me re nuk sjell vetëm shumë bezdi, por shkakton edhe shumë sëmundje. Uji me cilësi të ulët promovon depozitimin e kripërave, përshpejton procesin e plakjes së trupit dhe bëhet shkaku i kalimit të shumë sëmundjeve në fazën kronike. Përveç kësaj, klori përmban një numër substancash që mund të shkaktojnë kancer. Por uji është baza e të gjithë jetës dhe asnjë organizëm i vetëm i gjallë nuk mund të bëjë pa ujë. Për shembull, një person përbëhet nga uji me 60-65%. Prandaj, uji i pastër është jetik për çdo person. Fatkeqësisht, uji natyral në kohën tonë është plotësisht i papërshtatshëm për konsum pa trajtim paraprak, gjë që konfirmohet nga analiza të ndryshme të ujit. Të gjithë e dinë që stacionet e filtrimit, të cilat me sa duhet kryejnë pastrimin e ujit, prej kohësh kanë nevojë për riparime të mëdha, dhe sistemet e ujësjellësit përmes të cilave u dërgohet uji në shtëpitë tona kërkojnë zëvendësim.
Qëllimi i punës sonë ishte të studionim nivelin e ngurtësisë së ujit në vendlindjen tonë.
Ngurtësia e ujit dhe metodat për eleminimin e tij
Pse uji bëhet i vështirë
Kalciumi dhe përbërjet e tij janë shumë të domosdoshme për trupin: në fund të fundit, është nga ortofosfati i kalciumit Ca3 (P04) 2 që përbërjet e eshtrave dhe dhëmbëve të njerëzve dhe kafshëve. Ato formohen nga përbërës të tretshëm të kalciumit, i cili bart gjak në të gjithë trupin. Falë kationeve të kalciumit Ca2 +, gjaku është në gjendje të mpikset, duke formuar mpiksje, mpiksjen e plagëve dhe ndalimin e gjakderdhjes.
Komponimet e kalciumit nuk janë vetëm të dobishme, por edhe shumë të dëmshme - për shembull, kur ato i japin ngurtësinë ujit të zakonshëm. Në jetën e përditshme, fjala "ngurtësi", në shikim të parë, mund të zbatohet vetëm për solide: një stol parku ose një stol në kuzhinë mund të jetë i fortë. Sidoqoftë, uji është gjithashtu i vështirë.
Burimi kryesor i kripërave të magnezit dhe kalciumit që hyjnë në ujë janë depozitat e gurit gëlqeror, gips dhe dolomit që gërryhen nga ujërat natyrorë.
Në ujërat me kripë të ulët, shumica e joneve të kalciumit. Me një rritje të shkallës së mineralizimit, përmbajtja e joneve të kalciumit zvogëlohet me shpejtësi dhe rrallë tejkalon 1 g / l. Përmbajtja e joneve të magnezit në ujërat e mineralizuara mund të arrijë në disa gramë, dhe në ujërat e kripës disa dhjetëra gramë.
Fortësia e ujit - një kombinim i vetive kimike dhe fizike të ujit të shoqëruara me përmbajtjen e kripërave të tretura të metaleve alkaline të tokës në të, kryesisht kalcium dhe magnez. Uji me një përmbajtje të lartë të kripërave të tilla quhet ujë i fortë, me një përmbajtje të ulët - të butë. Ekzistojnë ngurtësi e përkohshme (karbonat) e formuar nga hidrokarburet dhe ngurtësia e përhershme (jokarbonati) e shkaktuar nga prania e kripërave të tjera. Ngurtësia e përkohshme është për shkak të pranisë së kalciumit dhe bikarbonateve të magnezit (Ca (HCO3) 2; Mg (HCO3) 2) në ujë. Ngurtësia e vazhdueshme e ujit është për shkak të pranisë në ujin e sulfateve, klorureve Ca dhe Mg (CaSO4, CaCl2, MgSO4, MgCl2).
Vlera e ngurtësisë së ujit në jetën e njeriut
Ngurtësia e ujit është shuma e joneve të kalciumit Ca2 + dhe magnezit Mg2 + të tretur në ujë.
Jonet e kalciumit dhe magnezit nuk i dëmtojnë shumë organizmat e gjallë, por prania e tyre në ujë në sasi të mëdha është e padëshirueshme, pasi uji i tillë është i papërshtatshëm për nevoja shtëpiake.
Në ujë të fortë, konsumi i sapunit dhe pluhurit rritet kur lani rrobat, mishi dhe perimet tretet ngadalë, dhe lëvizshmëria e stomakut zvogëlohet. Uji i fortë është i papërshtatshëm për sistemet e furnizimit me ujë dhe pajisjet e ngrohjes së ujit.
Fortësia matet në ekuivalentin e miligramave për litër (mEq / L). Standardet e industrisë për vlerat e lejuara të ngurtësisë varen nga lloji i pajisjeve të përdorura. Në mënyrë tipike, konsiderohet uji i fortë me fortësi 1 mEq / L ose më shumë.
Ngurtësia është problemi më i zakonshëm i cilësisë së ujit. Fillimisht, termi "ujë i fortë" u zbatua për ujin që ishte e vështirë për t'u larë.
Uji i fortë, kur lahet, thahet lëkurën, shkuma është formuar dobët në të kur përdorni sapun. Përdorimi i ujit të fortë shkakton që në muret e kaldajave, në tuba, etj të formohen sedimente (shkallë), etj. Në të njëjtën kohë, përdorimi i ujit shumë të butë mund të çojë në gërryerje të tubave, pasi që, në këtë rast, nuk ka asnjë tampon acid-bazë të siguruar nga hidrokarbonati (i përkohshëm) ngurtësi. Konsumimi i ujit të fortë ose të butë zakonisht nuk është i rrezikshëm për shëndetin, megjithëse ka prova se ngurtësi e lartë kontribuon në formimin e gurëve urinar, dhe i ulët - pak rrit rrezikun e sëmundjes kardiovaskulare.
Fortësia e ujërave natyrorë mund të ndryshojë mjaft gjerësisht dhe është e paqëndrueshme gjatë gjithë vitit. Ngurtësia rritet për shkak të avullimit të ujit, zvogëlohet gjatë sezonit të shirave, si dhe gjatë shkrirjes së borës dhe akullit.
Mënyrat për të eleminuar ngurtësinë
dalloj i përgjithshëm ngurtësi, e cila është e përbërë nga i përkohshëm dhe i përhershëm.
Vlimit.
i përkohshëm ngurtësia (e disponueshme ose e karbonatizuar) është për shkak të pranisë së Ca (HCO3) 2 dhe Mg (HCO3) 2 bikarbonate në ujë. Fortësia e karbonit lehtë për t’u hequr ujë të valënë të cilat Ca2 + dhe Mg2 + hiqen për të formuar precipitate të patretshme:
Ca (HCO3) 2 CaCO3 ↓ + CO2 + H2O
Jonet Mg precipitojnë në formën e karbonatit bazë ose në formën e hidroksidit të magnezit (në pH\u003e 10.3).
2Mg2 + + OH) 2CO3 ↓ + CO2 + H2O
(OH- jonet formohen për shkak të bashkëveprimit të joneve me ujë: dhe ekuilibri zhvendoset në të djathtë kur nxehet).
Për të zvogëluar ngurtësinë e karbonatit metoda e limonit në të cilën futet uji i trajtuar gëlqereCa (OH) 2. Reagimet që ndodhin me futjen e gëlqeres mund të shkruhen në formë molekulare:
Ca (HCO3) 2 + Ca (OH) 2 → 2CaCO3 ↓ + H2O
Mg (НСО3) 2 + Са (ОН) 2 → Mg (ОН) 2 ↓ + 2СаСО3 + Н2О
Ngurtësia e vazhdueshme (e parikuperueshme ose jo karbonatike) mbahet kur uji është zier, sepse ngurtësia e vazhdueshme është për shkak të pranisë në ujin e sulfateve, klorureve dhe kripërave të tjera të Ca dhe Mg. Në mënyrë sasiore, është e barabartë me përqendrimin e joneve Ca2 + dhe Mg2 + minus ngurtësinë e kohës. Zakonisht përdoret për të zvogëluar ngurtësinë e karbonatit. sode soda buke (Na2CO3)
MgSO4 + Na2CO3 → MgCO3 ↓ + Na2SO4
Ndërsa shtohet shter dhe sode mund të heqësh qafe ngurtësinë e karbonat dhe jo karbonat ( metoda e gëlqeres-sode).
E gjithë ngurtësia është eleminuar edhe me administratë fosfat natriumi, tetarbate natriumi dhe të tjerët. Meqenëse ortofosfatet janë më pak të tretshme se karbonatet, përdorimi i tyre në zbutjen e ujit është më i përshtatshëm:
3CaSO4 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 3Na2SO4
Mënyra moderne e zbutjes së ujit bazohet në përdorim rrëshirat e shkëmbimit jonik - shkëmbyesit jonikë (këmbyesit e kationit dhe këmbyesit e anionit). Shkëmbyesit e kationit janë rrëshira sintetike të shkëmbimit të joneve - aluminosilikate, për shembull:
Përbërja e tyre mund të shprehet me kusht me formulën e përgjithshme Na2R, ku Na + është një kation shumë i lëvizshëm dhe R - është një grimcë e shkëmbyesit të kationit që mbart një ngarkesë negative.
Kur uji i fortë rrjedh përmes një shtrese të rrëshirës së shkëmbimit të kationit, kationet shkëmbehen sipas reaksioneve:
Ca2 + + Na2R 2Na + + CaR
Mg2 + + + Na2R 2Na + + MgR
Kështu, jonet Ca2 + dhe Mg2 + kalojnë nga zgjidhja në rrëshirë të shkëmbimit të kationit. Për të rivendosur rrëshirën e shkëmbimit të kationit, ajo lahet me një zgjidhje të përqendruar të NaCl:
CaR + 2NaCl → CaCl2 + Na2R
Pas larjes, rrëshira e shkëmbimit të kationit mund të përdoret përsëri për të hequr ngurtësinë nga uji.
Osmoza e kundërt. Metoda bazohet në kalimin e ujit nëpër membranat gjysmë të depërtueshme (zakonisht poliamide). Së bashku me kripërat e fortësisë, shumica e kripërave të tjera gjithashtu hiqen. Efikasiteti i pastrimit mund të arrijë në 99.9%. Kjo metodë ka gjetur aplikimin më të madh në sistemet e trajtimit të ujit të pijshëm në familje. Si disavantazh i kësaj metode, duhet të theksohet nevoja për përgatitje paraprake të ujit të furnizuar në membranën e osmozës së kundërt.
Electrodialysis. Bazohet në largimin e kripërave nga uji me veprimin e një fushe elektrike. Heqja e joneve të substancave të tretura ndodh për shkak të membranave speciale. Ashtu si me teknologjinë e osmozës së kundërt, kripërat e tjera hiqen, përveç joneve të ngurtësisë.
Metoda termike. Bazuar në ngrohjen e ujit, eliminon vetëm ngurtësinë e përkohshme (karbonat). Gjeni aplikim në jetën e përditshme. Në industri përdoret, për shembull, në termocentralet.
Zbutja e reagentit. Metoda bazohet në shtimin e sode ose gëlqere të njomur në ujë. Në këtë rast, kripërat e kalciumit dhe magnezit kalojnë në përbërës të patretshëm dhe, si rezultat, precipitojnë. Kjo metodë është e justifikuar në konsumin relativisht të lartë të ujit, sepse shoqërohet me zgjidhjen e një numri problemesh specifike: llum filtrimi, dozim të saktë të reagentit.
këmbimit dosja. Metoda bazohet në përdorimin e ngarkesës kokrrizore të shkëmbimit jonik (më shpesh rrëshirat e shkëmbimit të joneve). Një kontakt i tillë, pas kontaktit me ujë, thith kationet e kripërave të ngurtësisë (kalcium dhe magnez). Në këmbim, në varësi të formës jonike, duke i dhënë larg joneve të natriumit ose hidrogjenit. Këto metoda përkatësisht quhen Na-kation dhe H-kation. Si rregull, ngurtësia e ujit zvogëlohet me një kationim të një natriumi me një fazë në 0.05-0.1 mEq / L, me një fazë dyfazore - në 0.01 mEq / L.
Reagenti më i mirë Për të eleminuar ngurtësinë e përgjithshme të ujit, otofosfati i natriumit është Na3PO4: 3Ca (HCO3) 2 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 6NaHCO3 3MgSO4 + 2Na3PO4 → Mg3 (PO4) 2 ↓ + 3Na2SO4 kalium shumë i dobët në kalium zbutje më e mirë e ujit. Në industri, duke përdorur filtrat e shkëmbimit të joneve, jonet e kalciumit dhe magnezit zëvendësohen nga jonet e natriumit dhe kaliumit për të prodhuar ujë të butë. Një zbutje e caktuar e ujit ndodh në filtrat shtëpiak për ujë të pijshëm. Uji i filtruar jep më pak shkallë. Uji mund të pastrohet plotësisht nga distilimi (distilimi).
Sot ka të shkëlqyera filtrat e ujit të cilat instalohen në apartament pa probleme dhe shërbejnë si një mjet i shkëlqyeshëm për trajtimin e ujit me cilësi të lartë. Ndoshta shumë njerëz sot preferojnë të blejnë ujë të pastruar në shishe në supermarkete. Zgjedhja e ujit të tillë është me të vërtetë e madhe, por a është e mundur të jesh 100% i sigurt për cilësinë e tij? Mbase jo! Kjo është arsyeja pse pastrimi i ujit me ndihmën e filtrave të dizajnuar posaçërisht për pastrimin është zgjidhja më optimale për një person modern që kujdeset për shëndetin e tij dhe shëndetin e të dashurve të tij. Sistemet e pastrimit të ujit janë shumë të larmishëm. Si rregull, ato ndryshojnë: performanca, disa parametra, shkalla e pastrimit të ujit, si dhe dizajni. Filtrat e ujit pastrojnë në mënyrë të përsosur ujin dhe e bëjnë atë të përshtatshme për pirje, zvogëlojnë përmbajtjen e aluminit, hekurit, manganit, klorit, të gjitha llojet e nitrateve në të. Përveç kësaj, filtrat për pastrimin e ujit ndihmojnë në eliminimin e erës së pakëndshme, shijes, si dhe të heqin qafe mikrobet dhe bakteret që përmbahen në ujë. Uji që është pastruar përmes sistemeve të tilla bëhet më pak i ngurtë, megjithatë, ai nuk humbet substanca të dobishme të nevojshme për trupin e njeriut. Filtrat e ujit janë një mundësi e shkëlqyeshme për të marrë ujë të pastruar në sasi të pakufizuar pa lënë shtëpinë tuaj. Një filtër i zgjedhur siç duhet do të jetë një zgjidhje e shkëlqyeshme për problemin e ujit të pastër, përmirësimin e shëndetit dhe zgjatjen e jetëgjatësisë.
Studimi i ngurtësisë së ujit dhe metodave për eleminimin e tij
Ngurtësia e ujit është për shkak të pranisë së joneve Ca2 + dhe Mg2 +. Sa më e lartë të jetë përmbajtja e tyre në ujë natyral (uji që kalon nëpër shkëmbinj guralecë dhe dhera), aq më i madh është ngurtësia e tij.
Në mënyrë sasiore, ngurtësia e ujit shprehet si shuma e milliequivalents e joneve Ca2 + dhe Mg2 + të përmbajtura në një litër ujë (meq / l). Një miliquivalent i ngurtësisë korrespondon me një përmbajtje prej 20.04 mg / L të joneve Ca2 + ose 12,16 mg / L të joneve Mg2 +.
Prandaj, kur zgjidhni probleme, mund të përdorni formulën:
(mmol - ekuiv / l),
ku m - masa e substancës që bën ngurtësinë e ujit ose përdoret për të eleminuar ngurtësinë e ujit, mg;
Mae- masë ekuivalente e kësaj substance, g / mol;
V- vëllimi i ujit, l
Për nga ngurtësia, të gjitha ujërat natyrore ndahen në butë(fortësi totale më pak se 2 mmol / l) dhe i ashpërme një shkallë mesatare të ngurtësisë (2-10 mmol / l) dhe një shkallë të lartë të ngurtësisë (më shumë se 10 mmol / l).
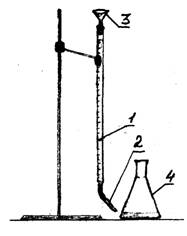
1 - buret
2 - pikatore
3 - gyp
Figura 1 - Vendosja eksperimentale
Përvoja e performancës
Në tre shishe, matni me një cilindër të madh të diplomuar 100 ml ujë. Shtoni 2-3 pika tregues metil portokalli në secilën balonë me ujë. Titrimi kryhet 0,1 N. solucion i acidit klorhidrik duke përdorur një buret. Vendosni nivelin e acidit në ndarjen e buretës në zero ndarje. Hidh acidin klorhidrik në mënyrë të pjerrët derisa ngjyra e zgjidhjes të ndryshojë nga e verdha në portokalli-rozë. Regjistroni sasinë e acidit që hyri në titrim. Përsëriteni titullin edhe dy herë. Vendosni të dhënat në tabelë.
Llogaritja bëhet sipas formulës:
![]() (mmol - ekuiv / l),
(mmol - ekuiv / l),
ku është përqendrimi normal i acidit klorhidrik;
Vcp ( HCl) - vëllimi mesatar HCl, shkuar për titrim;
Uji - vëllimi i ujit të marrë për titrim.
Të dhënat e marra ne kemi hartuar në formën e një tabele.
Mostër uji
përdoret për titrim
përdoret për titrimin e ujit të filtruar
Tap ujë - kabineti i kimisë
Uji nga çezma - rr. aviacion
Uji nga çezma - rr. tetor
Uji nga kolona - f. Bregdetare
Uji nga çezma - rr. Pokrovsky
Uji nga pusi - rr. Pokrovsky
Uji nga çezma - rr. Belgorod
Uji nga çezma - rr. ushtar
Ujë sode "e bukur"
Në kushtet e laboratorit shkollor, ne kemi kryer një studim të ujit të marrë nga burime të ndryshme për ngurtësinë. Për të përcaktuar ngurtësinë, u përdor titrimi i ujit natyral me acid klorhidrik në prani të një treguesi të metil portokalli. Fortësia e karbonatizuar e mostrës së ujit u përcaktua para dhe pas kalimit të tij përmes një filtri shtëpiak (u përdor Aquaphor).
Si rezultat i punës, u morën përfundimet e mëposhtme:
1) Uji në qytetin e Novy Oskol është i vështirë (W \u003d 7-10.5). Shumë njerëz jetojnë në sektorin privat dhe përdorin ujë nga puse, dhe ky ujë është shumë i vështirë.
2) Uji që hyn në ujësjellës i nënshtrohet pastrimit dhe zbutjes (L \u003d 6-7), prandaj mund të konsiderohet fortësi mesatare (sipas GOST, ngurtësia totale e ujit të pijshëm nuk duhet të jetë më shumë se 7 mmol / l).
3) Mënyra më e lehtë e bërë në shtëpi për të zbutur ujin është zierja tradicionale.
4) Eksperimentet kanë treguar që filtrat shtëpiakë gjithashtu zbutin në mënyrë të përsosur ujin. Pra, uji i marrë për hulumtime nga pusi në ul. Pokrovsky (ngurtësia 10.5 mmol / L), pas filtrimit, pati një ngurtësi prej vetëm 2 mmol / L, e cila është edhe më e ulët se norma fiziologjike (3.5 mmol / L). Kështu, filtrat e ujit janë një mundësi e shkëlqyeshme për të marrë ujë të pastruar në sasi të pakufizuar pa lënë shtëpinë tuaj.
Lista e referencave
1.,. një udhëzues për ushtrime praktike të higjienës me teknikën e hulumtimit sanitar. - M: "Mjekësia", 19.
2. dhe. Bazat e analizës kimike. Udhëzues studimi për studentët. - M .: "iluminizmi", 1971. - 192 f.
3. Kimi inorganike: Libër teksti. për teknolog spec. universitete. - M .: Më i lartë. shkollë., 1989 .-- 432 f.
4 ,. Ne monitorojmë mjedisin e qytetit tonë: klasat 9-11: Punëtori në shkollë. - M .: Njerëzimi. ed. VLADOS Center, 2001. - 112 f.
5. Kimi: Ref. ed. / B. Schroeter, K.-H. Lautenschleger, H. Bibrak et al.: Per. me të._ M .: Kimi, 1989. - Për. ed .: GDR, 1986.- 648 f.
Zinxhirët e transformimit
1. Karbonat kalcium Kaliumi oksid kalcium Hidroksid kalciumit kalcium nitrat.
2. Nitrat magnezi nitrat magnezi acidi magnezi magnez.
3. Klorium kalcium Kalcium sulfat kalcium sulfat kalcium sulfat kalcium hidroksid kalcium hidrokarbonat kalciumi.
4. Oksidi i Magnezit Magnezi Hidroksidi i Magnezit Kloruri i Magnezit Hidroksokarbonati i Magnezit Hydroksidi i Magnezit.
5. Oksidi i magnezit i sulfurit të magnezit ... hidroksidi i magnezit ... nitrati i magnezit.
6. Hidroksid kalcium kalcium kalcium karbonat kalcium oksid kalcium karbid kalcium hidrokarbonat kalciumi.
Detyrat e zgjidhjes
Niveli A
1. Ndërveprimi i 13.7 g metali me ujë lëshon 2.24 litra gaz (n.a.). Identifikoni metalin. Farë precipitimi dhe në cilën sasi është formuar nëse një zgjidhje shtesë e sulfatit të natriumit shtohet në zgjidhjen që rezulton?
vendim
Gazi (H 2) lëshohet gjatë bashkëveprimit të nëngrupeve M Ia dhe IIa me ujë.
Sipas ligjit të ekuivalentëve:
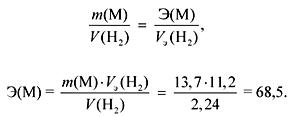
Nëse M Ia nëngrupe, atëherë
A r (M) \u003d E valencë \u003d 68.5 (nuk ka metal të tillë).
Nëse nëngrupet M IIa, atëherë
A r (M) \u003d E valencë \u003d 137 (Ba).
Ba + 2H 2 O \u003d Ba (OH) 2 + H 2,
Ba (OH) 2 + Na 2 SO 4 \u003d BaSO 4 + 2NaOH,
(BaSO 4) \u003d (Ba (OH) 2) \u003d (Ba) \u003d\u003d 0,1 mol,
m(BaSO 4) \u003d M\u003d 0,1 233 \u003d 23,3 g.
Përgjigja. Metal - Ba; m(BaSO 4) \u003d 23.3 g.
2. Cili vëllim prej 0.5 M zgjidhje hidroksidi i kalciumit duhet të shtohet në 81 g të një solucion 10% (densitet 1 g / cm 3) të bikarbonatit të kalciumit për të përfunduar formimin e sedimentit? Përcaktoni masën e sedimentit.
Përgjigja. 100 ml Ca (OH) 2, 10 g CaCO 3.
3. Zgjidhja që përmbante 23.3 g të një përzierjeje të sulfatit të kaliumit dhe kromit u ndikua nga një tepricë e klorurit të bariumit. رسivi u filtrua, u la, dhe pastaj u shtua një tepricë e acidit klorhidrik në të. Një pjesë e sedimentit u tret, pjesa e mbetur u filtrua, u la dhe u tha. Masa e sedimentit pas tharjes ishte 23.3 g. Përcaktoni përbërjen e përzierjes fillestare.
Përgjigja. 17.4 g K 2 SO 4 dhe 5.9 g të K 2 CrO 4.
4. Ekziston një përzierje e kalciumit, oksidit të kalciumit dhe karbidit të kalciumit me një raport molar të përbërësve të 1: 3: 4 (sipas renditjes së renditjes). Volumefarë vëllimi i ujit mund të hyjë në bashkëveprim kimik me 35 g të një përzierjeje të tillë?
Përgjigja. 17.568 ml.
5. Tretësira e hidroksidit të stronciumit në ujë në 100 ° C është 28 g, dhe në 25 ° C - 1 g për 100 g ujë. 200 g tretësirë \u200b\u200btë hidroksidit të stronciumit të ngopur në 100 ° C u ftohën në 25 ° C. Gjeni masën e hidroksidit të hidroksidit të stronciumit të precipituar kur zgjidhja ishte ftohur.
Përgjigja. 93.08 g Sr (OH) 2 8H 2 O.
Niveli B
1. Një masë e caktuar e karbonatit të magnezit kristalor u kalcinua deri sa pushoi evolucioni i gazit. Këto të fundit u kaluan përmes shisheve me ujë me acid sulfurik të përqendruar dhe ujë të gëlqeres. Masa e fllës së parë u rrit me 1.8 g, dhe në të dytën 2 g precipitati ra. Përcaktoni përbërjen e hidratit kristalin fillestar dhe masës së tij.
Përgjigja. MgCO 3 5H 2 O pentahidrat; 3.48 g
2. Raporti molar i karbonatit, bikarbonatit dhe nitratit të kalciumit në një përzierje që peshon 100 g është 1: 2: 3 (sipas renditjes së renditjes). Volumefarë vëllimi në 1200 ° C dhe presion normal do të marrin produktet e dekompozimit të gaztë të kësaj përzierje?
vendim
Ekuacionet e reaksioneve të dekompozimit të përbërësve të përzierjes:
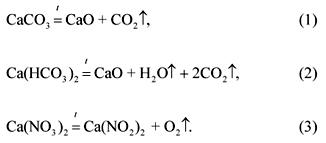
Sipas kushteve të problemit:
(CaCO 3): (Ca (HCO 3) 2): (Ca (JO 3) 2) \u003d 1: 2: 3.
Le (CaCO 3) \u003d x nishan.
Pastaj (Ca (HCO 3) 2) \u003d 2 x;
(Ca (JO 3) 2) \u003d 3 x;
100x + 162 2x +164 3x \u003d100,
x 0,109 mol.
në r \u003d 101.3 kPa dhe t \u003d 1200 ° C në gjendje të gaztë lëshohet:
CO 2 sipas ekuacionit (1):
1 (CO 2) \u003d (CaCO 3) \u003d x \u003d 0,109 mol;
H 2 O, CO 2 sipas ekuacionit (2):
2 (H 2 O) \u003d (Ca (HCO 3) 2) \u003d 2 x \u003d 0.218 mol,
2 (CO 2) \u003d 2 (Ca (HCO 3) 2) \u003d 4 x \u003d 0.436 mol;
O 2 sipas ekuacionit (3):
3 (O 2) \u003d (Ca (JO 3) 2) \u003d 3 x \u003d 0.327 mol.
Numri i përgjithshëm i moleve të produkteve të dekompozimit të gaztë:
0.109 + 0.218 + 0.436 + 0.327 \u003d 1.09 mol (n.a.).
Nga ekuacioni i gjendjes së gazrave idealë gjejmë vëllimin:
pV = RT,
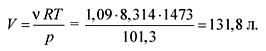
Përgjigja. V \u003d 131.8 litra
3. Një përzierje e sasive të barabarta të hidroksidit të metalit divalent dhe karbonatit u përcaktua. Masa e mbetjeve të ngurta doli të jetë 1.775 herë më pak se masa e përzierjes fillestare. Në këtë mbetje u shtua 10 herë një masë e madhe me 5% zgjidhje të acidit sulfurik. Llogaritni fraksionin në masë të substancave në zgjidhjen që rezulton.
Përgjigja. 6% MgSO 4.
4. Kur uji trajtohet me një përzierje të një hidride dhe nitride të një metali divalent me fraksione të barabarta në masë, u formua një përzierje gazi me një densitet hidrogjeni prej 2.658. Vendosni metalin e përfshirë në përbërjet (mos i rrumbullakoni numrat kur llogaritni!).
Përgjigja. Kalciumi.
5. Një pjatë e magnezit 16 g ra në një zgjidhje 16% të sulfatit të bakrit (II) me peshë 350 g. Kur pllaka u hoq, fraksionet masive të kripërave të përmbajtura në zgjidhje doli të ishin të njëjta. Sa herë është rritur masa e pllakës?
Përgjigja. 4,5 herë.
Detyrat e cilësisë
1. Cila nga këto substanca do të bashkëveprojë me hidroksidin e magnezit: acidi klorhidrik, acidi nitrik, dioksidi i karbonit, klorur natriumi, hidroksidi i bariumit, acidi sulfurik, oksidi i bakrit (II)?
Përgjigja. HCl, HNO 3, H 2 SO 4.
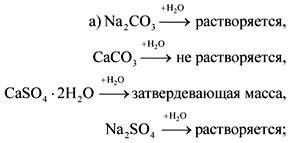
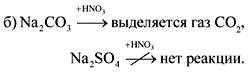
2. Në shishet pa etiketa janë sode, shkumës, gips dhe sulfat natriumi. Si mund të njihen këto substanca me ujin dhe acidin nitrik?
Përgjigja.
3. Substanca A është një metal i lehtë argjendi i bardhë me dritë, mjaft të fortë. Në bashkëveprimin e substancës A me B, që është një substancë e thjeshtë e gaztë, formohet komponimi C i cili është i tretshëm në ujë për të formuar një zgjidhje alkaline. Gjatë përpunimit të substancës Me acid sulfurik, formohet kripë, hidrati kristal i së cilës përdoret në ilaç për aplikimin e presioneve fiksuese për thyerje. Jepni ekuacionet e reaksionit.
Përgjigja. A është Ca; B është H2; C është CaH2; hidrat kristalor - CaSO 4 2H 2 O.
4. Substanca A është një oksid i tretshëm në ujë për të formuar një zgjidhje alkaline. Përbërësi B në këtë zgjidhje reagon me gaz pa erë C për të formuar një sediment të bardhë, i cili gradualisht shpërndahet ndërsa gazi C. kalon më tej.Jepni ekuacionet e reaksionit dhe identifikoni substancat.
Përgjigja. A është CaO, BaO; B është Ca (OH) 2, Ba (OH) 2; C është CO 2.
5. Substanca A, e cila është pjesë e një prej mineraleve më të zakonshme në koren e tokës, zbërthehet në temperaturë të lartë në dy okside, njëra prej të cilave B formohet gjithmonë në procesin e jetës. Kur substanca B bashkëvepron me grafit, kur nxehet, gazi C, i cili është toksik për kafshët me gjak të ngrohtë, është i ndezshëm, pa ngjyrë dhe pa erë. Jepni ekuacionet e reaksioneve, identifikoni substancat.
Përgjigja. A - CaCO 3; B është CO 2; C - CO.
Ngurtësia e ujit dhe eleminimi i tij
Abstrakt kimie
tema:"Ngurtësia e ujit"
Kontraktuesi i punës:Grabin Pavel.
plan
Hyrje 3
Përcaktimi i ngurtësisë së ujit. 3
Teknikat e ngurtësimit 4
Referencat 6
paraqitje
Në shpella, shpellat takohen me formacionet më të bukura gëlqerore - stalaktitet që varen nga harqet dhe stalagmitet që rriten lart. Nga pikëpamja e kimisë, shfaqja e këtyre krijimeve të mahnitshme të natyrës është ngurtësia e ujërave nëntokësorë. Ne e takojmë konceptin e ngurtësisë së ujit jo vetëm në speleologji dhe gjeologji, por, në përgjithësi, kudo - në kimi, teknologji dhe madje edhe në jetën e përditshme. Dhe për këtë arsye, ky koncept është shumë i rëndësishëm për përcaktimin e cilësisë së ujit.
Përcaktimi i ngurtësisë së ujit
Fortësia e ujit - pronë e ujit (për të mos larë, për të dhënë shkallë në kaldaja me avull) që lidhet me përmbajtjen e përbërësve të kalciumit dhe magnezit të tretshëm në të, ky është një parametër që tregon përmbajtjen e kationeve të kalciumit dhe magnezit në ujë.
Ngurtësia është vetitë e veçanta të ujit, të cilat kryesisht përcaktojnë cilësitë e tij të konsumatorit dhe për këtë arsye kanë vlerë të rëndësishme ekonomike. Uji i fortë formon shkallë në muret e kaldajave të ngrohjes, baterive, etj., Të cilat dukshëm degradojnë performancën e tyre termike. Një shtresë e tillë e hollë në sipërfaqen e ngrohjes nuk është aspak e padëmshme, pasi kohëzgjatja e ngrohjes përmes një shtrese shkalle që ka përçueshmëri të ulët termike gradualisht rritet, fundi digjet më shpejt dhe më shpejt - në fund të fundit, metali ftohet më ngadalë dhe ngadalë çdo herë, mbetet në një gjendje të nxehtë për një kohë të gjatë. Në fund të fundit, mund të ndodhë që fundi i anijes të mos i rezistojë dhe të lejojë rrjedhje. Ky fakt është shumë i rrezikshëm në industrinë ku ekzistojnë kaldaja me avull.
Uji i fortë nuk është i përshtatshëm për t'u larë. Shkalla në ngrohësit e makinave larëse i vendos ato pa rregull, gjithashtu përkeqëson vetitë e larjes së sapunit. Kationet Ca 2+ dhe Mg 2+ reagojnë me acide yndyrore të sapunit për të formuar kripëra të tretshme dobët, të cilat krijojnë filma dhe sedimente, duke reduktuar përfundimisht cilësinë e larjes dhe rritjen e konsumit të larësit, d.m.th. uji i forte nuk arrin te keqe
Ekzistojnë dy lloje të ngurtësisë: të përkohshëm dhe të përhershëm. Ky ndryshim është për shkak të llojit të anioneve që janë të pranishëm në zgjidhje si një kundërpeshë ndaj kalciumit dhe magnezit.
Ngurtësia e përkohshme shoqërohet me praninë në ujë së bashku me kationet Ca 2+, Mg 2+ dhe Fe 2+ të hidrokarbonatit, ose anioneve bikarbonate (HCO 3 -).
Ngurtësi e përhershme (ose jo karbonat) lind nëse sulfat, klorur, nitrat dhe anione të tjera janë të pranishme në tretësirë, kripërat e kalciumit dhe magnezit të të cilave janë mirë të tretshme dhe kështu thjesht nuk mund të hiqen. Fortësia totale përcaktohet si përmbajtja totale e të gjithë kripërave të kalciumit dhe magnezit në tretësirë.
Vende të ndryshme kanë standardet e tyre të ngurtësisë për ujin. Në vendin tonë, uji klasifikohet nga ngurtësia në këtë mënyrë:
Ujë i butë me ngurtësi më pak se 3.0 mEq / l,
Fortësia e mesme 3.0-6.0 mEq / L
Vështirë - më shumë se 6.0 mEq / ml.
Metodat për të eleminuar ngurtësinë.
Për të hequr qafe ngurtësinë e përkohshme, thjesht duhet të vloni ujë. Kur vlon ujë, anionet bikarbonate reagojnë me katione dhe formojnë kripëra karboni të tretshëm shumë dobët me to, të cilat precipitojnë.
Ca 2 + 2HCO 3 - \u003d CaCO 3 ↓ + H 2 O + CO 2
Me jonet e hekurit, reaksioni është më i komplikuar për shkak të faktit se FeCO 3 është një substancë e paqëndrueshme në ujë. Në prani të oksigjenit, produkti përfundimtar i zinxhirit të reaksionit është Fe (OH) 3, i cili është një precipitat i kuq i errët. Prandaj, sa më shumë hekur në ujë, aq më e fortë është ngjyra në shkallë, e cila depozitohet në muret dhe në fund të enës gjatë zierjes.
Ngurtësia e vazhdueshme është më e vështirë për të luftuar. Një opsion: ngrirja e akullit. Thjesht duhet të ngrini gradualisht ujin. Kur mbetet afërsisht 10% e lëngut nga sasia fillestare, është e nevojshme të kulloni ujin jo të ngrirë, dhe ta ktheni akullin në ujë. Të gjitha kripërat, të cilat formojnë një ngurtësi, mbeten në ujë jo të ngrirë.
Ushqimi është një mënyrë - distilimi, domethënë avullimi i ujit me kondensimin e tij të mëvonshëm. Meqenëse kripërat janë përbërës jo të paqëndrueshëm, ato mbeten, dhe uji avullon.
Por metoda të tilla si ngrirja dhe distilimi janë të përshtatshme vetëm për zbutjen e një sasie të vogël të ujit. Industria po merret me ton. Prandaj, përdoren metoda të tjera. Metoda më e përdorur për shkëmbimin e kationit, bazuar në përdorimin e reagentëve specialë - këmbyesve të kationeve, të cilët ngarkohen në filtra dhe kur uji kalohet përmes tyre, zëvendësoni kationet e kalciumit dhe magnezit me kation natriumi.
Me pasojën e ngurtësisë së shkallës së ujit, nga pikëpamja e kimisë, mund të luftoni shumë lehtë. Shtë e nevojshme të ndikoni në kripën e një acidi të dobët me një acid më të fortë. Kjo e fundit zë vendin e qymyrit, i cili, duke qenë i paqëndrueshëm, zbërthehet në ujë dhe dioksid karboni. Përbërja e shkallës mund të përfshijë silikate, dhe sulfate, dhe fosfate. Por nëse shkatërroni "skeletin" e karbonatizuar, atëherë këto përbërje nuk do të qëndrojnë në sipërfaqe.
Acidi adipik dhe anhidrati malik, të cilat shtohen në ujë, përdoren gjithashtu si agjentë zbritës. Këto substanca janë më të dobëta se acidi sulfamik, kështu që zierja është gjithashtu e nevojshme për zbritjen.
referencat:
Shpausus Z. Udhëtimi në botën e kimisë - Moskë: Arsimi, 1967. - 431s.
Kharlampovich G.D. dhe të tjerët.Kimi shumëpalëshe. - M .: Arsimi, 1992.-159 f.
Khomchenko G.P. Teksti i Kimisë –M .: Vala e Re, 1996. - 304p.
Ese të ngjashme:
Studimi i vetive të zgjidhjeve të holluara të poliarilateve duke marrë parasysh dy faktorë: konformimin e makromolekulave në zgjidhje dhe rendin orientues të molekulave tretës që i zgjidhin ato, i cili u gjykua nga parametrat termodinamikë dhe struktura e zgjidhjes.
Qëllimi dhe struktura e filtrave jonite të saktë paralel të fazës së parë dhe të dytë, veprim i përzier. Karakterizimi i teknologjisë së jonizimit kundërpeshë. Përshkrimi i metodës natrium-kation të zbutjes së ujit. Parimet e desalination dhe desalination e ujit.
Shkëmbyesit e kationit dhe pronat e tyre. Procesi i zbutjes së ujit nga kationizimi i natriumit. Zbutës i ujit për shkëmbimin e hidrogjen-natriumit-kation. Metodat e kationizimit të kalko-kationit dhe të pjesshëm. Filtrat e shkëmbimit të kationit dhe pajisjet ndihmëse të instalimeve të shkëmbimit të kationit.
Farë është shkuma dhe surfaktantët. Tensioni sipërfaqësor si karakteristika më e rëndësishme e ndërfaqes fazore. Metodat e studimeve eksperimentale të ndikimit të ngurtësisë së ujit në shkumëzimin dhe qëndrueshmërinë e shkumës për lloje të ndryshme të surfaktantëve.
Karakteristikat e ujit dhe metodat e zbutjes së tij. Kërkesat për ngurtësinë e ujit të konsumuar në industrinë e nxehtësisë dhe energjisë. Bazat teorike dhe metodat për përcaktimin e ngurtësisë së ujit duke përdorur metodën komplekometrike. Mostrimi, reagentët, përcaktimi.
Prodhimi i karbonit nga dekompozimi termik i drurit, thithja e substancave të tretura dhe gazrat nga qymyri. Ndërveprimi i dioksidit të karbonit me alkali, prodhimin e monoksidit të karbonit dhe studimin e vetive të tij. Njohja me vetitë e karbonateve dhe bikarbonateve.
Treguesit e kushtëzuar të cilësisë së ujit të pijshëm. Përcaktimi i substancave organike në jonet e ujit, bakrit dhe plumbit. Metodat për të eleminuar ngurtësinë e ujit. Mënyrat për të pastruar ujin. Përgatitja e një zgjidhje pune të sulfatit të kaliumit. Pastrimi i ujit me ngrirje të pjesshme.
Karakteristikat kimike të kalciumit. Përdorimi i karbonatit të kalciumit të pastër në optikë, gur gëlqeror në metalurgji - si fluks. Gips si një hidrat kristalor i sulfatit të kalciumit. Kripë kalciumi i acidit fosforik si përbërësi kryesor i fosforit dhe apatiteve.
Shumëllojshmëria e komponimeve të karbonit, shpërndarja e tyre në natyrë dhe aplikimi. Modifikimet alotropike. Karakteristikat fizike dhe struktura e atomit të karbonit të lirë. Karakteristikat kimike të karbonit. Karbonat dhe bikarbonatet. Struktura e diamantit dhe grafitit.
Karakterizimi i litosferës, përbërja e elementeve kimike dhe mineraleve në koren e tokës. Struktura, përbërja kimike dhe funksionet e hidrosferës, atmosferës. Karakteristikat e fotosintezës së substancave organike që ndodhin në biosferë. Studimi i proceseve biogjeokimike.
Fortësia e lartë e ujit në sistemet e ngrohjes dhe ujit të ngrohtë shtëpiak ndikon negativisht në proceset e transferimit të nxehtësisë, duke rritur konsumin e energjisë. Për më tepër, uji i pijshëm i vështirë është i dëmshëm për shëndetin e njeriut. Për ujin për qëllime të ndryshme, përdoren metoda të ndryshme zbutjeje.
Zbutja e ujit është procesi i heqjes së kripërave të ngurtësisë nga uji. Por çfarë është ngurtësia e ujit dhe pse duhet të hiqet?
Koncepti i ngurtësisë së ujit zakonisht shoqërohet me katione të kalciumit (Ca 2+) dhe, në një masë më të vogël, magnez (Mg 2+). Në fakt, të gjithë kationet divalentë në një shkallë ose në një tjetër ndikojnë në ngurtësinë. Ata bashkëveprojnë me anione, duke formuar komponime (kripëra të fortësisë) që mund të precipitojnë.
Kripërat e hekurit, manganit dhe stronciumit gjithashtu mund të precipitojnë, por në praktikë të gjithë këta elementë kanë një efekt kaq të vogël në ngurtësi sa që zakonisht shpërfillen.
Alumini (Al 3+) dhe hekuri ferrik (Fe 3+) gjithashtu ndikojnë në ngurtësinë, por në nivelet e pH që gjenden në ujërat natyrorë, tretshmëria e tyre dhe, në përputhje me rrethanat, "kontributi" në ngurtësi është i papërfillshëm. Në mënyrë të ngjashme, efekti i parëndësishëm i bariumit (Ba 2+) nuk merret parasysh.
Llojet e ngurtësisë
Ekzistojnë disa lloje të ngurtësisë së ujit. Fortësia totale përcaktohet nga përqendrimi i përgjithshëm i joneve të kalciumit dhe magnezit. Shtë shuma e ngurtësisë së karbonatit (të përkohshëm) dhe jo karbonat (të përhershëm).
Ngurtësia e karbonatit është për shkak të pranisë së hidrokarbureve dhe karbonateve në ujë (në pH\u003e 8.3). Ngurtësia e përkohshme karakterizohet nga prania në ujë së bashku me kationet Ca 2+, Mg 2+ dhe Fe 2+ të hidrokarbonatit, ose anioneve bikarbonate (HCO 3-). Ky lloj ngurtësie është eliminuar pothuajse plotësisht nga uji i valë dhe kjo është arsyeja pse quhet ngurtësi e përkohshme. Kur uji nxehet, hidrokarbonatet dekompozohen për të formuar acidin karbonik dhe precipitojnë karbonat kalciumi, hidroksid magnezi dhe hekuri.
Ngurtësia jo karbonatike është për shkak të pranisë së kripërave të kalciumit dhe magnezit të acideve të forta (sulfurik, nitrik, hidroklorik) dhe nuk eliminohet nga zierja, prandaj ka marrë emrin e ngurtësisë së vazhdueshme.
njësitë e matjes
Në praktikën botërore, përdoren disa njësi të ngurtësisë, të gjitha lidhen në një mënyrë të caktuar me njëri-tjetrin.
Njësia e ngurtësisë merret si ngurtësia e ujit, në 1 l të së cilës përmban 1 mmol ekuivalentë të Ca 2+ ose Mg 2+. Një njësi e ngurtësisë (1 mmol / L) korrespondon me përmbajtjen e joneve të kalciumit të barabartë me 20.04 mg / L ose joneve të magnezit të barabartë me 12.15 mg / L. Fortësia totale e ujit (H) mund të llogaritet me formulën:
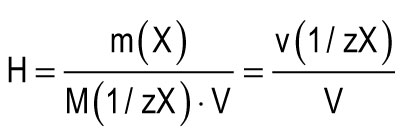
m (X) është masa e substancës së tretur, mg; M (1 / zX) është masa molare e ekuivalentit të substancës, mg / mmol (g / mol); V është vëllimi i ujit, l; M (1 / zCa 2+) \u003d 20.04 mg / mmol; M (1 / zMg 2+) \u003d 12.15 mg / mmol.
Për më tepër, njësitë e ngurtësisë të tilla si shkalla gjermane (,d, dH), shkalla frënge ()f), diploma amerikane dhe ppm CaCO 3 përdoren gjerësisht në vendet e huaja.
Raporti i këtyre njësive të ngurtësisë është paraqitur në tabelë. 1.
Tabela 1. Raporti i njësive të ndryshme të ngurtësisë
Pra, një shkallë gjermane korrespondon me 10 mg / dm 3 CaO ose 17.86 mg / dm 3 CaCO 3 në ujë. Një shkallë franceze është 10 mg / dm 3 CaCO 3 në ujë, dhe shkalla amerikane është e barabartë me 1 mg / dm 3 CaCO 3 në ujë.
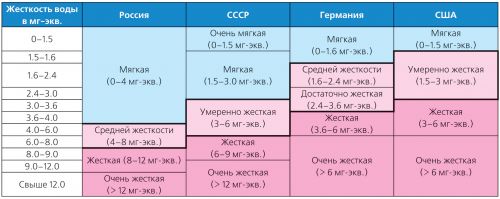
Fortësia e ujit ndryshon gjerësisht dhe ka shumë lloje të klasifikimeve. Pra, në Gjermani, zbatohen standardet e ngurtësisë së Institutit Gjerman për Standardizim (DIN 19643), dhe në Sh.B.A. - klasifikimi i miratuar nga Agjencia e Mbrojtjes së Mjedisit (USEPA) në 1986 (Tabela 2).
Tabela 2. Klasifikimi i llojeve të ndryshme të ngurtësisë
Cili ujë është më i butë
Në mënyrë tipike, në ujërat me mineral të ulët, ngurtësia mbizotëron për shkak të joneve të kalciumit (megjithëse në disa raste të rralla, ngurtësia e magnezit mund të arrijë 50-60%). Me një rritje të shkallës së mineralizimit të përgjithshëm të ujit, përmbajtja e joneve të kalciumit (Ca 2+) shpejt zvogëlohet dhe rrallë tejkalon 1 g / l. Përmbajtja e joneve të magnezit (Mg 2+) në ujëra shumë të mineralizuara mund të arrijë në disa gram, dhe në liqenet e kripës - dhjetëra gramë për litër ujë.
Në përgjithësi, ngurtësia e ujit sipërfaqësor është përgjithësisht më pak se ngurtësia e ujërave nëntokësorë. Ngurtësia e ujit sipërfaqësor është subjekt i luhatjeve të dukshme sezonale, zakonisht duke arritur vlerën e saj më të madhe në fund të dimrit dhe më të ultën gjatë përmbytjes, kur ajo hollohet me bollëk me shi të butë dhe shkrihet ujë. Uji i detit dhe oqeanit kanë një ngurtësi shumë të lartë (dhjetëra e qindra meq / l).
Pasojat e ngurtësisë
Uji i pijshëm i vështirë është i hidhur për shkak të shijes së magnezit dhe ka një efekt negativ në sistemin e tretjes. Sipas standardeve të Organizatës Botërore të Shëndetit (OBSH), ngurtësia optimale e ujit të pijshëm është 1.0-2.0 mEq / l.
Produktet ushqimore treten dobët në ujë të fortë, pasi kationet e kalciumit me proteina ushqimore formojnë përbërës të pazgjidhshëm; ulet vlera ushqyese e tyre. Përdorimi i vazhdueshëm i ujit të fortë mund të çojë në depozitimin e kripërave (urolithiasis) në trupin e njeriut.
Teaji dhe kafeja pjeken dobët në ujë të tillë. Në kushtet shtëpiake, një tepricë e kripërave të ngurtësisë çon në shkallëzimin e sipërfaqeve të ngrohjes në kaldaja, çajra, tuba, depozitimi i kripërave në ndeshjeve hidraulike dhe dështimi i tyre, të lënë një depozitë në flokët dhe lëkurën e një personi, duke krijuar një ndjesi të pakëndshme të "ngurtësisë" së tyre.
Fortësia e ujit të përdorur për të përgatitur produkte të ndryshme rregullohet qartë dhe është në nivelin prej 0,1-0,2 mEq / l.
Uji i fortë formon shkallë në muret e kaldajave të ngrohjes, baterive, etj., Gjë që dëmton ndjeshëm performancën e tyre termike, zvogëlon seksionin e lirë të tubacioneve.
Tubacionet rriten me depozita në shkallë aq shumë sa produktiviteti i tyre bie disa herë. Prandaj, në ato procese ku përdorimi i ujit me një përmbajtje të caktuar kripe është i lejueshëm, ngurtësia e tij është e kufizuar në vlera edhe më të ulëta - 0.03-0.05 mEq / l.
Shkalla e ngrohësve të makinave larëse i vë ato jashtë rregullit. Kur lani, bashkëveproni me substanca me sipërfaqe aktive (sipërfaqe vepruese) të sapunit ose pastruesve të lavanderi, kripërat e fortësisë i lidhin ato dhe kërkojnë më shumë konsum. Uji i ngurtë nuk mund të përdoret kur kryhen procese të caktuara teknologjike, për shembull, gjatë pikturës, në elektrokimi, etj.
Largimi i kripës
Proceset e nxjerrjes së kripërave Ca 2+ dhe Mg 2+ nga uji në trajtimin e ujit quhen zbutje të ujit.
Largimi relativisht selektiv i kripërave të ngurtësisë nga uji mund të bëhet me metoda:
- trajtimi i nxehtësisë;
- distilim;
- zbutja e reagentit;
- ngrirje;
- përpunimi magnetik;
- përpunimi tejzanor;
- shkëmbimi jonik;
- osmozë e kundërt.
Janë të njohura edhe metodat e trajtimit të ujit (efektet elektromagnetike, shtimi i polifosfateve ose "anti-shkallë"), të cilat lejojnë të "lidhin" kripërat e ngurtësisë për një kohë, duke i parandaluar ato të bien në formën e shkallës për ca kohë. Sidoqoftë, këto metoda nuk neutralizojnë kimikisht kripërat e ngurtësisë, nuk i heqin ato në të vërtetë, dhe për këtë arsye kanë gjetur përdorim të kufizuar në trajtimin e ujit industrial.
Zbutje termike
Në këtë mënyrë, ata heqin qafe ngurtësinë e përkohshme të shkaktuar nga bikarbonatet e kalciumit dhe magnezit. Kur vlon ujë, hidrokarburet dekompozohen për të formuar një sediment të karbonatit mesatar ose themelor:
Ca (HCO 3) 2 \u003d CaCO 3 ↓ + CO 2 + H 2 O,
Mg (HCO 3) 2 \u003d Mg 2 (OH) 2 CO 3 ↓ + 3CO 2 + H 2 O.
Si rezultat, ngurtësia e ujit është zvogëluar. Kjo është arsyeja pse ngurtësia e bikarbonatit quhet e përkohshme.
Me jonet e hekurit, reaksioni është më i komplikuar për shkak të faktit se FeCO 3 është një substancë e paqëndrueshme në ujë. Në prani të oksigjenit, produkti përfundimtar i zinxhirit të reaksionit është Fe (OH) 3, i cili është një precipitat i kuq i errët. Prandaj, sa më shumë hekur në ujë, aq më e fortë është ngjyra në shkallë, e cila depozitohet në muret dhe në fund të enës gjatë zierjes.
Kështu, kur vlon ujë në jetën e përditshme, ndodh njëkohësisht procesi i zbutjes së pjesshme të tij.
distilim
Distilimi është një metodë tradicionale, efektive dhe e besueshme që siguron një shkallë të lartë të pastrimit të ujit shumë të kripur me kripë të lartë dhe ngurtësi.
Parimi i përgjithshëm i marrjes së ujit me anë të kësaj metode është si vijon: uji i pijshëm i përgatitur paraprakisht hyn në distilues, i cili përbëhet nga tre përbërës kryesorë: një avullues, një kondensator dhe një koleksionues.
Avulluesi me ujë nxehet në një çiban. Avujt e ujit hyjnë në kondensator, ku lëngshëm dhe në formën e distilës hyjnë në kolektor. Të gjitha papastërtitë jo të paqëndrueshme të pranishme në ujin e burimit mbeten në distilator.
Për të marrë ujë të pastruar, përdoren distilatorë, të cilët ndryshojnë nga njëri-tjetri në mënyrën e ngrohjes, produktivitetit dhe tipareve të projektimit.
Metoda e distilimit të vetëm është joekonomik, pasi që kur përdoret, ka kosto të lartë energjie për ngrohje dhe avullim (rreth 3000 kJ për 1 kg avull), si dhe konsumimi i ujit për kondensimin e avullit (rreth 8 litra ujë 1 kg avull). Prandaj, përdorimi i një distilimi të vetëm këshillohet për konsum të ulët të ujit - 10-20 l / h.
Më efikase dhe ekonomike sesa distilimi konvencional janë distiluesit me shumë kolonë të performancës së lartë. Por ato janë jashtëzakonisht të shtrenjta, përveç kësaj, kostot e para-trajtimit të ujit për ta janë të larta.
Vlen të përmendet se metoda e distilimit heq të gjitha kripërat e tretura në ujin e burimit.
Aplikimi i reagentit
Ka zbutje të ujit me anë të gypave, sode-liming dhe sode-natrium të ujit zbutës.
Kur limoni, gëlqereja e hidratuar Ca (OH) 2 i shtohet zgjidhjes me një pH prej rreth 10. Si rezultat, reagimet vijojnë:
Ca (HCO 3) 2 + Ca (OH) 2 \u003d 2 CaCO 3 + 2H 2 O,
Mg (HCO 3) 2 + 2Ca (OH) 2 \u003d Mg (OH) 2 + 2СaCO 3 + 2Н 2 O.
Kjo metodë përdoret për ngurtësinë e lartë të karbonateve dhe të ulët jo karbonatike të ujit, kur kërkohet një ulje e njëkohshme e ngurtësisë dhe alkalinitetit. Ngurtësia e mbetur është 0.4-0.8 mEq / L më e lartë se ngurtësia jo karbonatike.
Kur shtohet gëlqere sode, gëlqereje e tharë Ca (OH) 2 dhe sode Na 2 CO 3 shtohen në ujë me një pH prej rreth 10. Si rezultat, ndodhin reagimet e mëposhtme:
Ca (HCO 3) 2 + Ca (OH) 2 + Na 2 CO 3 \u003d 2 CaCO 3 + 2NaOH + H2 CO 3,
Mg (HCO 3) 2 + 2NaOH \u003d Mg (OH) 2 + 2NaHCO 3.
Siç vijon nga ekuacionet e reaksionit, në procesin e formimit dhe sedimentimit të sedimentit nga uji, kripërat e fortësisë nxirren. Së bashku me ta, grimcat koloidale dhe të pezulluara me ndotje shoqëruese hiqen. Sedimenti organik pihet pjesërisht në thekon e sedimentit.
Me limfatim sode, për shkak të tepricës së joneve HCO 3, arrihet një kompletim më i madh i heqjes së kripërave të ngurtësisë nga uji. Ngritja e temperaturës në 70-80 ° C ju lejon të sillni ngurtësinë e mbetur në 0.35-1.0 mEq / L. Rezultati i njëjtë mund të arrihet duke rritur doza të reagentëve.
Metoda e sode sode
Shtimi i sode është i nevojshëm nëse ngurtësia jo karbonatike është më e madhe se karboni. Nëse këto parametra janë të barabartë, shtimi i sode mund të mos jetë aspak i nevojshëm.
Hidrokarburet e kalciumit dhe magnezit në reagim me alkalin formojnë përbërës të dobët të tretshëm të kalciumit dhe magnezit, sode, ujë dhe dioksid karboni:
Ca (HCO 3) 2 + 2NaOH \u003d CaCO 3 ↓ + Na 2 CO 3 + 2H 2 O,
Mg (HCO 3) 2 + 2NaOH \u003d Mg (OH) 2 ↓ + Na 2 CO 3 + H2 O + CO 2.
Dioksidi i karbonit i formuar si rezultat i reagimit të karbonatit të hidrogjenit të magnezit me alkalin reagon përsëri me alkali për të formuar sode dhe ujë:
CO 2 + NaOH \u003d Na 2 CO 3 + H 2 O.
Ngurtësia jo karbonatike
Sulfati dhe kloruri i kalciumit reagojnë me sode të formuar në reagimet e ngurtësisë së karbonatit dhe alkali dhe sode të shtuar për të formuar karbonat kalciumi që nuk ngjitet në kushte alkaline:
CaCl 2 + Na 2 CO 3 \u003d CaCO 3 ↓ + 2NaCl,
CaSO 4 + Na 2 CO 3 \u003d CaCO 3 ↓ + Na 2 SO 4.
Sulfati i magnezit dhe kloruri reagojnë me alkali për të formuar hidroksid magnez të precipituar:
MgSO 4 + 2NaOH \u003d Mg (OH) 2 ↓ + Na 2 SO 4,
MgCl 2 + 2NaOH \u003d Mg (OH) 2 ↓ + 2NaCl.
Për shkak të faktit se në reaksionet e bikarbonatit me alkali, formohet sode, e cila më pas reagon me ngurtësinë jo karbonatike, sasia e saj duhet të lidhet në raportin e ngurtësisë së karbonatit (LFA) dhe jo-karbonatit (LFA):
- nëse janë të barabartë, sode mund të lihet;
- nën gjendjen Lc\u003e Lnc, formohet një tepricë sode;
- me raportin e LCD< Жнк - недостаток соды и ее необходимо добавлять.
Proceset e depozitimit kryhen në rezervuarë dhe sqarues me një shtresë të pezulluar të sedimentit.
Rezervuarët e sedimentimit janë joefikas dhe pulpat hidroksid i përftuar në to ka një lagështi të lartë 97-99%. Prandaj, ato aktualisht praktikisht nuk përdoren.
Në praktikë, përdoren versione të ndryshme të sqaruesve me një shtresë sedimenti të pezulluar. Në to, zgjidhja që duhet të pastrohet furnizohet nga poshtë dhe kalon nëpër shtresën e sedimentit. Kjo rrit koeficientin e pastrimit të ujit.
Metodat e reagentit nuk përdoren në përgatitjen e ujit të pijshëm. Pas tyre, uji ka një reagim fort alkalik. Prandaj, reagentët përdoren gjerësisht në energji dhe industri si faza e parë e pastrimit të filtrave mekanikë. Kur punoni së bashku, ata ju lejojnë të zbutni ujin, hiqni solidet e pezulluara, përfshirë koloidet, dhe pastroni pjesërisht ujin nga substancat organike.
ngrirje
Për të luftuar ngurtësinë e vazhdueshme të ujit, përdoret një metodë e tillë si ngrirja e akullit. Për ta bërë këtë, ju vetëm duhet të ngrini gradualisht ujin. Kur afërsisht 10% e lëngut mbetet nga sasia fillestare, është e nevojshme që të kulloni ujin jo të ngrirë, dhe kthimin e akullit përsëri në ujë. Të gjitha kripërat që formojnë ngurtësinë mbeten në ujë të ngrirë.
Së bashku me distilimin, është në të njëjtën kohë një nga mënyrat për të desalinizuar ujin shumë të kripur në cilësi të pijshëm.
Metoda të tjera
Metoda e elektrodializës bazohet në fenomenin e lëvizjes së drejtuar të joneve të elektrolitit në elektroda të lidhura me një rrjet të rrymës direkte. Kështu, jonet metalike, të cilat përcaktojnë ngurtësinë e ujit, bllokohen në elektroda dhe ndahen nga uji duke lënë aparatet e trajtimit të ujit.
Metoda e jonizimit magnetik përdor gjithashtu fenomenin e lëvizjes së drejtuar të joneve, por tashmë nën ndikimin e një fushe magnetike. Për të rritur numrin e joneve në ujë, rrezatohet paraprakisht me rrezatim jonizues.
Trajtimi magnetik i ujit konsiston në kalimin e ujit përmes një sistemi fushash magnetike të drejtimeve të kundërta. Si rezultat i kësaj, vërehet një ulje në shkallën e hidratimit të substancave të tretura dhe kombinimi i tyre në grimca më të mëdha që precipitojnë.
Trajtimi tejzanor i ujit gjithashtu çon në formimin e grimcave më të mëdha të substancave të tretura me formimin e sedimentit.
Këshillohet që në pjesën e dytë të artikullit të konsideroni metodën e shkëmbimit të joneve dhe proceset e osmozës së kundërt, të cilën do t'i botojmë në revistën tonë në numrin tjetër.
