ජල දෘ ness තාව සහ එය තුරන් කිරීම. IA උප සමූහයේ ලෝහ සඳහා කාර්යයන් සහ අභ්\u200dයාස
පිටුව 1
තාවකාලික දෘ ness තාව තුරන් කිරීම උතුරන වතුර මගින් සිදු කෙරේ. තාපාංකයෙන් පසු හයිඩ්\u200dරොකාබනේට් විනාශ වන අතර දුර්වල ලෙස ද්\u200dරාව්\u200dය කාබනේට් වර්ෂාපතනය වේ. සෝඩියම් කාබනේට්, කැල්සියම් හයිඩ්\u200dරොක්සයිඩ් ජලයට හඳුන්වා දුන් විට ජලයේ සම්පූර්ණ දෘ ness තාව ඉවත් කෙරේ. මෙම අවස්ථාවේ දී, කාබනේට් දෘ ness තාව හුණු මගින් ඉවත් කරනු ලබන අතර, කාබනේට් නොවන දෘ ness තාව සෝඩා මගින් ඉවත් කරනු ලැබේ.
තාවකාලික දෘ ness තාව ඉවත් කිරීමට අමතරව, දෙහි සියළුම මැග්නීසියම් සහ යකඩ ජලයෙන් ඉවත් කරන අතර කාබනික හා අකාබනික කොලොයිඩ්වල කැටි ගැසීම ප්\u200dරවර්ධනය කරයි.
අපද්\u200dරව්\u200dය පිරිසිදු කිරීමෙන් පසු, තාවකාලික දෘ ness තාව සහ විරූපණය ඉවත් කිරීමෙන්, වේශ නිරූපණ තාප හුවමාරුව (2) වෙත සපයනු ලැබේ, එහිදී එය 335 K දක්වා රත් කරනු ලැබේ. මිශ්\u200dර කිරීමෙන් පසු, වේශ නිරූපණය සහ ආපසු ජලය තාප හුවමාරුවේ (2) දෙවන කලාපයට පොම්ප කරනු ලැබේ, එහිදී එය 355 K දක්වා රත් කර ගලා යයි තාපන ජාල.
සංවෘත සංසරණ ජල සැපයුම් පද්ධතිවල පාඩු (නැවත ආරෝපණය කිරීම) සහ සංසරණය වන ජලය සමඟ ස්පර්ශ වන විට තාප හුවමාරුව සහ සිසිලන පෘෂ් aces යන්හි ඛනිජ අපවිත්\u200dර වීම වැළැක්වීම සඳහා නිර්මාණය කර ඇති තාවකාලික ජල දෘ ness තාව තුරන් කිරීම සඳහා මෘදු කිරීම බොහෝ විට භාවිතා වේ. බොහෝ අවස්ථාවන්හීදී, සංසරණ ජලයේ කැල්සියම් අයන සහ ජෛව කාබනේට් සමුච්චය කිරීමේ ප්\u200dරධාන ප්\u200dරභවය වේශ නිරූපණ ජලය වන අතර, ඉහළ වාෂ්පීකරණ සංගුණක සහිත පද්ධතිවල සංසරණ ජලයේ ස්ථායී සංයුතිය කඩාකප්පල් කළ හැකිය.
තාවකාලික දෘ ness තාව තුරන් කිරීම සඳහා ජලය මෘදු කිරීම රසායනිකව සිදු කරනු ලබන්නේ හුණු, සල්ෆියුරික් හෝ හයිඩ්\u200dරොක්ලෝරික් අම්ලය ලෙස භාවිතා කරන ප්\u200dරතික්\u200dරියාකාරක හඳුන්වා දීමෙනි. රසායනික ක්\u200dරම සාපේක්ෂව නොගැඹුරු ජල මෘදු කිරීමක් ලබා ගනී. වැඩි මෘදු කිරීමක් සඳහා, කැටායන හුවමාරු ක්\u200dරම භාවිතා කරනු ලබන අතර, එහි සාරය නම් ජලයේ දෘ hard තාවයේ ලවණ කැටායන සඳහා ඒවායේ අඩංගු සෝඩියම් කැටායන හුවමාරු කර ගැනීමට ඇතැම් ද්\u200dරව්\u200dයවල හැකියාව භාවිතා කිරීමයි.
ජලයේ තාවකාලික දෘ ness තාව තුරන් කිරීම සඳහා ජලයෙහි රසායනික අපවිත්\u200dර කිරීම සඳහා ශාකවල භාවිතා කරන ඇනොවිටික් ෆිල්ටර පුනර්ජනනය කිරීම සඳහා කෝස්ටික් සෝඩා තාප බලාගාරවල භාවිතා වේ.
තාවකාලික ජල දෘ ness තාව තුරන් කිරීම සහ රසායනික ඩෙසලීනේෂන් කම්හල්වල භාවිතා කරන අයනික පෙරහන් නැවත උත්පාදනය කිරීම සඳහා කෝස්ටික් සෝඩා තාප බලාගාරවල භාවිතා වේ.
ඒ හා සමානව, තාවකාලික තද බව ඉවත් කිරීම සඳහා අවශ්\u200dය Ca (OH) 2 ප්\u200dරමාණයද ගණනය කළ යුතුය.
මැග්නීසියම් ලවණ නිසා ඇති වන තාවකාලික තද බව ඉවත් කිරීම සඳහා කැල්සියම් ලවණ නිසා ඇති වන තාවකාලික තද බව ඉවත් කිරීමට වඩා වැඩි හුණු ප්\u200dරමාණයක් අවශ්\u200dය වේ.
එබැවින්, සංවෘත (පිරිසිදු-රහිත) ජල සැපයුම් පද්ධති නැවත ආරෝපණය කිරීම සඳහා, වේශ නිරූපණ ජලය සාපේක්ෂව ගැඹුරු මෘදු කිරීම සහ තාවකාලික දෘ ness තාව තුරන් කිරීම සිදු කළ යුතුය.
ක්ෂාරීය ප්\u200dරතික්\u200dරියාකාරක කුඩා ප්\u200dරමාණයක් හඳුන්වාදීම මඟින් ජලයෙහි චුම්භක ප්\u200dරතිකාරයේ කාර්යක්ෂමතාව වැඩි කරයි, නමුත් ක්ෂාරීය ප්\u200dරතික්\u200dරියාකාරක හඳුන්වාදීම, නිදසුනක් ලෙස, තාවකාලික තද බව ඉවත් කිරීම සඳහා අවශ්\u200dය වන ප්\u200dරමාණයෙන් 10 - 20% ට නොඅඩු ප්\u200dරමාණයකින් යුත් දෙහි, 1959 දී ඛීඅයි හි සිදු කරන ලද අධ්\u200dයයනයන්ට අනුව, පරිමාණ සෑදීම අඩු කරයි. 8 සිට 10 වතාවක්.
මෙම අවස්ථාවේ දී, බයිකාබනේට් නිසා ඇති වන අස්ථි හයේ ජලය ඉවත් කරනු ලැබේ. එමනිසා, මෙම තද බව තාවකාලික හෝ බයිකාබනේට් ලෙස හැඳින්වේ. එබැවින් තාවකාලික තද බව ඉවත් කිරීම සඳහා ජලය උනු කිරීමට ප්රමාණවත්ය.
නිරන්තර දෘඩතාවයේ ලවණ, උදාහරණයක් ලෙස, CaCl, CaSO4, ආදිය රත් වූ විට ජලයෙන් ඉවත් නොකෙරේ. ජලය වාෂ්පීකරණය කිරීමේදී ඒවා වේගවත් වන අතර උපකරණයේ බිත්ති මත form න පරිමාණය ඉවත් කිරීමට අපහසු වේ. Hard න ජලය භාවිතා කළ හැක්කේ එහි භාවිතයේ කොන්දේසි solid න ප්\u200dරපාතයේ වර්ෂාපතනයට හේතු නොවන අවස්ථාවන්හිදී පමණි, නිදසුනක් ලෙස, ශීතකරණවල දී සිසිල් ජලය තාවකාලික දෘඩතාව තුරන් කිරීමට උපකාරී වන උෂ්ණත්වයකට රත් නොවේ. බොයිලර් පැලෑටි වල ජලය රත් වූවා පමණක් නොව වාෂ්ප වන අතර තාවකාලික පමණක් නොව නිරන්තර දෘ hard තාවද පිළිගත නොහැකිය. එබැවින් විශේෂ ශාකවල රසායනික ක්\u200dරමයක් මගින් කැල්සියම් සහ මැග්නීසියම් ලවණ වලින් ජලය පිරිසිදු කරනු ලැබේ.
නාගරික අධ්\u200dයාපන ආයතනය
"ද්විතීයික පාසල් අංක 1
තනි විෂයයන් පිළිබඳ ගැඹුරු අධ්\u200dයයනයක් සමඟ
ලිපිනය: බෙල්ගොරොඩ් කලාපය,
ජල දෘ ness තාව පරීක්ෂණය
සහ එය තුරන් කිරීමේ ක්\u200dරම
ශිෂ්\u200dය 11 "A" පන්තියේ අවබෝධතා ගිවිසුම "සාමාන්\u200dයය
ද්විතීයික පාසල් අංක 1
ගැඹුරු අධ්\u200dයයනයක් සමඟ
තනි අයිතම
ලිපිනය: බෙල්ගොරොඩ් කලාපය,
විද්\u200dයාත්මක උපදේශක:,
රසායන විද්\u200dයා ගුරුවරයා
ද්විතීයික පාසල් අංක 1
ගැඹුරු අධ්\u200dයයනයක් සමඟ
තනි අයිතම
නොවි ඔස්කොල්, බෙල්ගොරොඩ් කලාපය
ලිපිනය: බෙල්ගොරොඩ් කලාපය,
නවී ඔස්කොල්,
නවී ඔස්කොල්
1. හැඳින්වීම ……………………………………………………… .3
2. ජල දෘ ness තාව සහ එය තුරන් කිරීමේ ක්\u200dරම ………………………… .4
Water ජලය අමාරු වන්නේ ඇයි .............................................................. 4
Life මිනිස් ජීවිතයේ ජල දෘ ness තාවයේ වටිනාකම ...................................... 4
Sti තද බව තුරන් කිරීමේ ක්\u200dරම …………………………………… ... 5
3. ජල දෘ ness තාව සහ එය තුරන් කිරීමේ ක්\u200dරම අධ්\u200dයයනය කිරීම .............. ... 8
4. නිගමනය සහ නිගමන
5. යොමු ලැයිස්තුව
හැඳින්වීම
විද්\u200dයාව හැදෑරූ නමුත් ඒවා අදාළ නොකරන්නේ කවුද?
සීසාන නමුත් වපුරන්නේ නැති තැනැත්තාට සමානය.
සාඩි
විසිවන සියවසේ 80 දශකයේ දී පෝල් චැපියස් බ්\u200dරැග්ගේ පොත් නිරෝගී දිවිපෙවෙතක් ප්\u200dරවර්ධනය කිරීම පිළිබඳ පොත් පළ විය. බොහෝ විද්වතුන් ඔහුගේ මතය මතභේදාත්මක යැයි සැලකුවද, පෝල් බ්\u200dරැග්ගේ පොත් අවධානයට ලක්විය යුතුය. ඔහුගේ පොතේ එක් කොටසක් (දෘ hard තාව පිළිබඳ මගේ පළමු අත්හදා බැලීම්) ජල දෘ hard තාව පිළිබඳ ගැටලුව සඳහා කැපවී ඇති අතර, කතුවරයා සිය මතක සටහන් වල විස්තර කර ඇත්තේ ඔහුගේ සීයාගේ රෝගී තත්වය විස්තර කර ඇති අතර, ඔහුගේ රුධිර වාහිනී hard න ජලයෙන් පෙලඹී මියගිය බවත්, ඒවායේ කොටස්වල ජීවත් වූ කාන්තාව ( අවාසනාවන්ත කාන්තාව ගල් කාන්තාවක් ලෙස හැඳින්වූයේ ඇගේ සිරුර ලවණ විශාල ප්\u200dරමාණයක් නිසා වචනාර්ථයෙන් සුරතල් වූ බැවිනි). එම කාන්තාව තද ජලයට ගොදුරු වූ බොහෝ දෙනාගෙන් කෙනෙකි. අවාසනාවන්ත අවයව එවැනි ජලයේ අඩංගු අකාබනික ද්\u200dරව්\u200dය විශාල ප්\u200dරමාණයක් සැකසීමට අපොහොසත් වූ අතර ඒවා ඇගේ ශරීරයේ ඉතා ක්\u200dරියාශීලීව එකතු වීමට පටන් ගත්තේය.
කැල්සියම් සංයෝග වකුගඩු ගල් හා පිත්තාශයේ ස්වරූපයෙන් අපේ ශරීරයේ වේගවත් වේ.
අද වන විට ජල පිරිපහදු කිරීම විනෝදකාමී හා විනෝදකාමී දෙයක් නොව අත්\u200dයවශ්\u200dය අවශ්\u200dයතාවකි. කාරණය නම්, අපිරිසිදු සංසිද්ධීන්, තෙවන පාර්ශවීය කුඩු, සුවඳ මෙන්ම වලාකුළු සහිත වර්ෂාපතනයක් තිබීම බොහෝ අපහසුතාවන්ට හේතු වනවා පමණක් නොව, බොහෝ රෝග ඇති කරයි. අඩු ගුණාත්මක ජලය ලවණ තැන්පත් වීම ප්\u200dරවර්ධනය කරයි, ශරීරයේ වයසට යාමේ ක්\u200dරියාවලිය වේගවත් කරයි, සහ බොහෝ රෝග නිදන්ගත වීමට හේතු වේ. ඊට අමතරව, ක්ලෝරීන් පිළිකා ඇති කළ හැකි ද්\u200dරව්\u200dය ගණනාවක් අඩංගු වේ. නමුත් ජලය සියලු ජීවීන්ගේ පදනම වන අතර ජලය නොමැතිව එක ජීවියෙකුටවත් කළ නොහැකිය. උදාහරණයක් ලෙස, පුද්ගලයෙකු 60-65% ක ජලයකින් සමන්විත වේ. එබැවින් සෑම පුද්ගලයෙකුටම පිරිසිදු ජලය අත්\u200dයවශ්\u200dය වේ. අවාසනාවකට මෙන්, අපේ කාලයේ ස්වාභාවික ජලය මූලික ප්\u200dරතිකාර නොමැතිව පරිභෝජනයට සම්පූර්ණයෙන්ම නුසුදුසු වන අතර එය ජලය පිළිබඳ විවිධ විශ්ලේෂණයන් මගින් සනාථ වේ. ජල පවිත්\u200dරකරණය යැයි කියනු ලබන පෙරහන් මධ්\u200dයස්ථානවලට බොහෝ කලක සිට විශාල අලුත්වැඩියාවක් අවශ්\u200dය වී ඇති බවත්, අපේ නිවෙස්වලට ජලය ලබා දෙන ජල සැපයුම් පද්ධති ප්\u200dරතිස්ථාපනය අවශ්\u200dය බවත් කවුරුත් දනිති.
අපගේ කාර්යයේ පරමාර්ථය වූයේ අපේ ගමෙහි ජල දෘ ness තාවයේ මට්ටම අධ්\u200dයයනය කිරීමයි.
ජල දෘ ness තාව සහ එය තුරන් කිරීමේ ක්\u200dරම
ජලය අමාරු වන්නේ ඇයි?
කැල්සියම් සහ එහි සංයෝග ශරීරයට ඉතා අත්\u200dයවශ්\u200dය වේ: සියල්ලට පසු, මිනිසුන්ගේ සහ සතුන්ගේ අස්ථි හා දත් සෑදී ඇත්තේ කැල්සියම් ඕතොපොස්පේට් Ca3 (P04) 2 ය. ඒවා සෑදී ඇත්තේ ශරීරය පුරා රුධිරය ගෙන යන ද්\u200dරාව්\u200dය කැල්සියම් සංයෝගවලිනි. කැල්සියම් කැටායන Ca2 + ට ස්තූතිවන්ත වන අතර, රුධිරය කැටි ගැසීමට, කැටි ගැසීම් ඇති කිරීමට, තුවාල වළක්වා ගැනීමට සහ ලේ ගැලීම නැවැත්වීමට හැකියාව ඇත.
කැල්සියම් සංයෝග ප්\u200dරයෝජනවත් පමණක් නොව ඉතා හානිකර වේ - නිදසුනක් ලෙස ඒවා සාමාන්\u200dය ජලයට දෘ ness තාව ලබා දෙන විට. එදිනෙදා ජීවිතයේ දී, "තද ගතිය" යන වචනය බැලූ බැල්මට යෙදිය හැක්කේ ids න ද්\u200dරව්\u200dයවලට පමණි: උද්\u200dයාන බංකුවක් හෝ මුළුතැන්ගෙයෙහි පුටුව .න විය හැකිය. කෙසේ වෙතත්, ජලය ද දුෂ්කර ය.
ජලයට ඇතුළු වන මැග්නීසියම් සහ කැල්සියම් ලවණවල ප්\u200dරධාන ප්\u200dරභවය වන්නේ ස්වාභාවික ජලයෙන් ඛාදනය වන හුණුගල්, ජිප්සම් සහ ඩොලමයිට් නිධි ය.
අඩු ලවණ සහිත ජලයේ බොහෝ කැල්සියම් අයන. ඛනිජකරණයේ වැඩි වීමත් සමඟ කැල්සියම් අයනවල අන්තර්ගතය වේගයෙන් අඩු වන අතර කලාතුරකින් 1 g / l ඉක්මවයි. ඛනිජකරණය වූ ජලයේ ඇති මැග්නීසියම් අයනවල අන්තර්ගතය ග්\u200dරෑම් කිහිපයකට ළඟා විය හැකි අතර ලුණු ජලයේ ග්\u200dරෑම් දස දහස් ගණනක් ඇත.
ජල දෘ ness තාව - ක්ෂාරීය පෘථිවි ලෝහවල ද්\u200dරාවිත ලවණවල අන්තර්ගතයට සම්බන්ධ ජලයේ රසායනික හා භෞතික ගුණාංගවල එකතුවකි, ප්\u200dරධාන වශයෙන් කැල්සියම් සහ මැග්නීසියම්. එවැනි ලවණවල ඉහළ අන්තර්ගතයක් සහිත ජලය දෘඩ ජලය ලෙස හැඳින්වේ, අඩු අන්තර්ගතයක් සහිත - මෘදුයි. හයිඩ්\u200dරොකාබනේට් මගින් සාදන ලද තාවකාලික තද බව (කාබනේට්) සහ අනෙකුත් ලවණ තිබීම නිසා ස්ථිර ff නතාව (කාබනේට් නොවන) ඇත. කැල්සියම් සහ මැග්නීසියම් බයිකාබනේට් (Ca (HCO3) 2; Mg (HCO3) 2) ජලයේ තිබීම තාවකාලික තද ගතියට හේතු වේ. නිරන්තර ජල දෘ ness තාව ඇති වන්නේ සල්ෆේට්, Ca සහ Mg ක්ලෝරයිඩ් (CaSO4, CaCl2, MgSO4, MgCl2) වල ජලය තිබීමයි.
මිනිස් ජීවිතයේ ජල දෘ ness තාවයේ වටිනාකම
ජලයේ දෘ ness තාව යනු ජලයේ දියවන කැල්සියම් අයන Ca2 + සහ මැග්නීසියම් Mg2 + එකතුවයි.
කැල්සියම් සහ මැග්නීසියම් අයන ජීවීන්ට එතරම් හානියක් නොකරන නමුත් ජලයේ විශාල ප්\u200dරමාණයක් තිබීම නුසුදුසු බැවින් එවැනි ජලය ගෘහ අවශ්\u200dයතා සඳහා නුසුදුසු ය.
Hard න ජලයේ, ඇඳුම් සේදීමේදී සබන් හා කුඩු පරිභෝජනය වැඩි වන අතර මස් හා එළවළු සෙමෙන් ජීර්ණය වන අතර ආමාශයේ චලනය අඩු වේ. ජල සැපයුම් පද්ධති සහ ජල තාපන උපකරණ සඳහා දෘ water ජලය නුසුදුසු ය.
දෘ ness තාව මනිනු ලබන්නේ මිලිග්\u200dරෑම් ලීටරයකට සමාන (mEq / L) ය. අවසර ලත් තදබල අගයන් සඳහා කර්මාන්ත ප්\u200dරමිතීන් රඳා පවතින්නේ භාවිතා කරන උපකරණ වර්ගය මත ය. සාමාන්\u200dයයෙන් 1 mEq / L හෝ ඊට වැඩි දෘඩතාවයකින් යුත් water න ජලය සැලකේ.
දෘ hard තාව යනු ජලයේ වඩාත් පොදු ගැටළුවයි. මුලදී, “තද ජලය” යන යෙදුම සෝදා ගැනීමට අපහසු ජලයට යොදන ලදි.
Water න ජලය, සේදූ විට, සම වියළී යයි, සබන් භාවිතා කරන විට පෙන එහි දුර්වල ලෙස සෑදී ඇත. Hard න ජලය භාවිතා කිරීම බොයිලේරු වල බිත්තිවල, පයිප්පවල අවසාදිත (පරිමාණය) සෑදීමට හේතු වේ. ඒ අතරම, අධික මෘදු ජලය භාවිතා කිරීම පයිප්ප විඛාදනයට හේතු විය හැක, මන්ද මේ අවස්ථාවේ දී, හයිඩ්\u200dරොකාබනේට් මගින් සපයන ඇසිඩ්-පාදක බෆරයක් නොමැත. (තාවකාලික) තද ගතිය. දෘඩ හෝ මෘදු ජලය පරිභෝජනය කිරීම සාමාන්\u200dයයෙන් සෞඛ්\u200dයයට අහිතකර නොවේ, ඉහළ දෘඩතාව මුත්රා සෑදීමට දායක වන බවට සාධක තිබුණද, අඩු - හෘද වාහිනී රෝග අවදානම තරමක් වැඩි කරයි.
ස්වාභාවික ජලයේ දෘ ness තාව බෙහෙවින් වෙනස් විය හැකි අතර එය වසර පුරා අස්ථාවර වේ. ජලය වාෂ්ප වීම නිසා දෘ ness තාව වැඩි වේ, වැසි සමයේදී මෙන්ම හිම හා අයිස් දියවන විටද අඩු වේ.
තද බව තුරන් කිරීමේ ක්\u200dරම
වෙන්කර හඳුනා ගන්න සමස්තයක් ලෙස තද බව, එය සමන්විත වේ තාවකාලිකයි සහ නියත.
තාපාංකය.
තාවකාලික Ca (HCO3) 2 සහ Mg (HCO3) 2 බයිකාබනේට් 2 ජලයේ තිබීම නිසා තද බව (ඉවත දැමිය හැකි හෝ කාබනේට්) ඇතිවේ. කාබන් දෘ ness තාව ඉවත් කිරීමට පහසුය උතුරන වතුරCa2 + සහ Mg2 + ඉවත් කර ද්\u200dරාව්\u200dය ප්\u200dරපාතයන් ඇති කරයි:
Ca (HCO3) 2 CaCO3 ↓ + CO2 + H2O
Mg අයන මූලික කාබනේට් ස්වරූපයෙන් හෝ මැග්නීසියම් හයිඩ්\u200dරොක්සයිඩ් ස්වරූපයෙන් (pH\u003e 10.3 දී) වර්ෂාපතනය වේ.
2Mg2 + + OH) 2CO3 ↓ + CO2 + H2O
(ජලය සමඟ අයන අන්තර්ක්\u200dරියා කිරීම නිසා OH- අයන සෑදී ඇත: රත් වූ විට සමතුලිතතාවය දකුණට මාරු වේ).
කාබනේට් දෘ ness තාව අඩු කිරීම සඳහා සීමා කිරීමේ ක්\u200dරමය පිරිසිදු ජලය හඳුන්වා දෙන දෙහිCa (OH) 2. හුණු හඳුන්වාදීමත් සමඟ සිදුවන ප්\u200dරතික්\u200dරියා අණුක ආකාරයෙන් ලිවිය හැකිය:
Ca (HCO3) 2 + Ca (OH) 2 → 2CaCO3 ↓ + H2O
Mg (НСО3) 2 + Са () 2 → Mg (ОН) 2 ↓ + 2СаСО3 + Н2О
ජලය තම්බන විට නිරන්තර දෘ ness තාව (සොයාගත නොහැකි හෝ කාබනේට් නොවන) පවත්වා ගෙන යනු ලබන්නේ නිරන්තර දෘ hard තාව නිසා සල්ෆේට්, ක්ලෝරයිඩ් සහ Ca සහ Mg වල අනෙකුත් ලවණ වල ජලය තිබීමයි. ප්\u200dරමාණාත්මකව, එය Ca2 + සහ Mg2 + අයනවල සාන්ද්\u200dරණයට සමාන වේ. සාමාන්\u200dයයෙන් කාබනේට් දෘ ness තාව අඩු කිරීමට භාවිතා කරයි. ගණනය කර ඇත සෝඩා (Na2CO3):
MgSO4 + Na2CO3 → MgCO3 ↓ + Na2SO4
එකතු කරන අතරතුර දෙහි සහ සෝඩා ඔබට කාබනේට් සහ කාබනේට් නොවන දෘ ness තාව ඉවත් කළ හැකිය ( දෙහි-සෝඩා ක්\u200dරමය).
සියලු දෘඩතාව සමඟ පවා ඉවත් කරනු ලැබේ හැඳින්වීම සෝඩියම් පොස්පේට්, සෝඩියම් ටෙට්\u200dරබොරේට් ඕතොපොස්පේට් කාබනේට් වලට වඩා අඩු ද්\u200dරාව්\u200dය බැවින් ජල මෘදු කිරීම සඳහා ඒවා භාවිතා කිරීම වඩාත් පහසු වේ:
3CaSO4 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 3Na2SO4
ජලය මෘදු කිරීමේ නවීන ක්\u200dරමය පදනම් වේ භාවිතා කිරීම අයන හුවමාරු ෙරසින් - අයන හුවමාරුකාරක (කැටායන හුවමාරු කරුවන් සහ අයන හුවමාරු කරුවන්). කැටායන හුවමාරු කරන්නන් කෘතිම අයන හුවමාරු දුම්මල වේ - ඇලුමිනොසිලිකේට්, උදාහරණයක් ලෙස:
Na2R යන සාමාන්\u200dය සූත්\u200dරය මගින් ඒවායේ සංයුතිය කොන්දේසි සහිතව ප්\u200dරකාශ කළ හැකිය, එහිදී Na + ඉතා ජංගම කැටායනයක් වන අතර R - a ණ ආරෝපණයක් දරණ කැටායන හුවමාරු අංශුවකි.
කැටායන හුවමාරු දුම්මල තට්ටුවක් හරහා hard න ජලය ගලා යන විට, ප්\u200dරතික්\u200dරියා අනුව කැටායන හුවමාරු වේ:
Ca2 + + Na2R → 2Na + + CaR
Mg2 + + + Na2R → 2Na + + MgR
මේ අනුව, Ca2 + සහ Mg2 + අයන ද්\u200dරාවණයේ සිට කැටායන හුවමාරු දුම්මලයට ගමන් කරයි. කැටායන හුවමාරු දුම්මල යථා තත්වයට පත් කිරීම සඳහා, එය NaCl හි සාන්ද්\u200dරිත ද්\u200dරාවණයකින් සෝදා ඇත:
CaR + 2NaCl → CaCl2 + Na2R
සේදීමෙන් පසු, කැටායන හුවමාරු දුම්මල නැවත ජලයෙන් තද බව ඉවත් කිරීමට භාවිතා කළ හැකිය.
ප්\u200dරතිලෝම ඔස්මෝසිස්. මෙම ක්\u200dරමය පදනම් වී ඇත්තේ අර්ධපරිමාණ පටල (සාමාන්\u200dයයෙන් පොලිමයිඩ්) හරහා ජලය ගමන් කිරීම මත ය. දෘ hard තාව ලවණ සමඟ අනෙක් බොහෝ ලවණ ද ඉවත් කරනු ලැබේ. පිරිසිදු කිරීමේ කාර්යක්ෂමතාව 99.9% දක්වා ළඟා විය හැකිය. මෙම ක්\u200dරමය ගෘහස්ථ පානීය ජල පිරිපහදු පද්ධතිවල විශාලතම යෙදුම සොයාගෙන ඇත. මෙම ක්\u200dරමයේ අවාසියක් ලෙස, ප්\u200dරතිලෝම ඔස්මෝසිස් පටලයට සපයන ජලය මූලික වශයෙන් සකස් කිරීමේ අවශ්\u200dයතාවය සැලකිල්ලට ගත යුතුය.
විද්යුත් විච්ඡේදනය එය පදනම් වී ඇත්තේ විද්\u200dයුත් ක්ෂේත්\u200dරයක ක්\u200dරියාකාරිත්වය මගින් ජලයෙන් ලවණ ඉවත් කිරීම මත ය. විසුරුවා හරින ලද ද්\u200dරව්\u200dයවල අයන ඉවත් කිරීම සිදුවන්නේ විශේෂ පටල නිසාය. ප්\u200dරතිලෝම ඔස්මෝසිස් තාක්\u200dෂණය මෙන්, දෘ hard තාව අයන වලට අමතරව අනෙකුත් ලවණ ඉවත් කරනු ලැබේ.
තාප ක්\u200dරමය. ජල උණුසුම මත පදනම්ව, තාවකාලික (කාබනේට්) තද බව පමණක් ඉවත් කරයි. එදිනෙදා ජීවිතයේදී යෙදුම සොයා ගනී. කර්මාන්තයේ දී එය තාප බලාගාරවල භාවිතා වේ.
ප්\u200dරතික්\u200dරියාකාරක මෘදු කිරීම. මෙම ක්\u200dරමය පදනම් වී ඇත්තේ සෝඩා හෝ ස්ලැක් කළ දෙහි වතුරට එකතු කිරීමෙනි. මෙම අවස්ථාවේ දී, කැල්සියම් සහ මැග්නීසියම් ලවණ ද්\u200dරාව්\u200dය නොවන සංයෝගවලට ඇතුළු වන අතර එහි ප්\u200dරති prec ලයක් ලෙස වර්ෂාපතනය වේ. මෙම ක්\u200dරමය සාපේක්ෂව ඉහළ ජල පරිභෝජනයකදී යුක්ති සහගත වන්නේ එය විශේෂිත ගැටළු ගණනාවක විසඳුම සමඟ සම්බන්ධ වී ඇති බැවිනි: රොන්මඩ පෙරීම, ප්\u200dරතික්\u200dරියාකාරකයේ නිවැරදි මාත්\u200dරාව.
කැටායනකරණය. මෙම ක්\u200dරමය පදනම් වී ඇත්තේ අයන හුවමාරු කැටිති පැටවීම (බොහෝ විට අයන හුවමාරු දුම්මල) භාවිතය මත ය. එවැනි සම්බන්ධතා ජලය සමඟ ස්පර්ශ වූ විට දෘ hard තාවයේ ලවණ (කැල්සියම් සහ මැග්නීසියම්) කැටායන අවශෝෂණය කරයි. හුවමාරුවේදී, අයනික ස්වරූපය මත පදනම්ව, සෝඩියම් හෝ හයිඩ්\u200dරජන් අයන ලබා දෙයි. මෙම ක්\u200dරම පිළිවෙලින් Na-cation සහ H-cation ලෙස හැඳින්වේ. රීතියක් ලෙස, ජලයේ දෘ ness තාව තනි-අදියර සෝඩියම් කැටායනයකින් 0.05-0.1 mEq / L දක්වාත්, අදියර දෙකකින් - 0.01 mEq / L දක්වාත් අඩු වේ.
හොඳම ප්\u200dරතික්\u200dරියාකාරකය ජලයේ සාමාන්\u200dය දෘ ness තාව තුරන් කිරීම සඳහා සෝඩියම් ඔටොපොස්පේට් යනු Na3PO4: 3Ca (HCO3) 2 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 6NaHCO3 3MgSO4 + 2Na3PO4 → Mg3 (PO4) 2 ↓ + 3Na2SO4 වඩා හොඳ ජලය මෘදු කිරීම. කර්මාන්තයේ දී අයන හුවමාරු පෙරහන් භාවිතා කරමින් මෘදු ජලය නිපදවීම සඳහා කැල්සියම් සහ මැග්නීසියම් අයන සෝඩියම් සහ පොටෑසියම් අයන මගින් ප්\u200dරතිස්ථාපනය වේ. පානීය ජලය සඳහා ගෘහස්ථ පෙරහන් වල යම් නිශ්චිත මෘදු කිරීමක් සිදු වේ. පෙරූ ජලය අඩු පරිමාණයක් ලබා දෙයි. ආසවනය (ආසවනය) මගින් ජලය සම්පූර්ණයෙන්ම පිරිසිදු කළ හැකිය.
අද විශිෂ්ටයි ජල පෙරහන් ඒවා ගැටළු නොමැතිව මහල් නිවාසයේ ස්ථාපනය කර ඇති අතර උසස් තත්ත්වයේ ජල පිරිපහදු සඳහා විශිෂ්ට මෙවලමක් ලෙස සේවය කරයි. සමහර විට අද බොහෝ දෙනෙක් සුපිරි වෙළඳසැල්වල බෝතල් කළ පිරිසිදු ජලය මිලදී ගැනීමට කැමැත්තක් දක්වති. එවැනි ජලය තෝරා ගැනීම සැබවින්ම අති විශාලය, නමුත් එහි ගුණාත්මකභාවය පිළිබඳව 100% ක් විශ්වාස කළ හැකිද? සමහර විට නැත! පිරිසිදු කිරීම සඳහා විෙශේෂෙයන් නිර්මාණය කරන ලද ෙපරහන් ආධාරයෙන් ජලය පිරිසිදු කිරීම නූතන පුද්ගලයකුෙග් සෞඛ්\u200dයය හා තම ආදරණීයයන්ගේ සෞඛ්\u200dයය ගැන සැලකිලිමත් වන වඩාත් සුදුසුම විසඳුම වන්නේ එබැවිනි. ජල පිරිපහදු කිරීමේ පද්ධති ඉතා විවිධාකාර වේ. රීතියක් ලෙස, ඒවා වෙනස් වේ: කාර්ය සාධනය, සමහර පරාමිතීන්, ජලය පිරිසිදු කිරීමේ මට්ටම මෙන්ම සැලසුම් කිරීම. ජලය පෙරීම මගින් ජලය හොඳින් පිරිසිදු කර පානය කිරීමට සුදුසු වන අතර ඇලුමිනියම්, යකඩ, මැන්ගනීස්, ක්ලෝරීන්, එහි ඇති සියලුම නයිට්රේට් අන්තර්ගතය අඩු කරයි. මීට අමතරව, ජලය පිරිසිදු කිරීම සඳහා වන පෙරහන් අප්රසන්න ගන්ධය, රසය මෙන්ම ජලයේ අඩංගු විෂබීජ හා බැක්ටීරියා ඉවත් කිරීමට උපකාරී වේ. එවැනි පද්ධති හරහා පිරිසිදු කර ඇති ජලය අඩු දෘඩ බවට පත්වේ, කෙසේ වෙතත්, එය මිනිස් සිරුරට අවශ්\u200dය ප්\u200dරයෝජනවත් ද්\u200dරව්\u200dය නැති නොකරයි. ඔබේ නිවසින් පිටව නොගොස් අසීමිත ප්\u200dරමාණවලින් පිරිසිදු ජලය ලබා ගැනීමට ජල පෙරහන් යනු කදිම අවස්ථාවකි. නිසි ලෙස තෝරාගත් පෙරණයක් පිරිසිදු ජලය පිළිබඳ ගැටලුවට, සෞඛ්\u200dයය වැඩි දියුණු කිරීමට සහ ඔබේ දීර් onge ායුෂ දීර් to කිරීමට විශිෂ්ට විසඳුමක් වනු ඇත.
ජල දෘ ness තාව සහ එය තුරන් කිරීමේ ක්\u200dරම අධ්\u200dයයනය කිරීම
ජල දෘ ness තාව ඇති වන්නේ Ca2 + සහ Mg2 + අයන පැවතීම හේතුවෙනි. ස්වාභාවික ජලයේ ඒවායේ අන්තර්ගතය වැඩි වන විට (ජලය පාෂාණ හා පස් හරහා ගමන් කරයි), එහි දෘ ness තාව වැඩි වේ.
ප්\u200dරමාණාත්මකව ගත් කල, ජල දෘ ness තාව ප්\u200dරකාශ වන්නේ ජලය ලීටරයක (මෙක් / එල්) අඩංගු Ca2 + සහ Mg2 + අයනවල මිලිමීටරවල එකතුව ලෙස ය. දෘ hard තාවයේ එක් මිලිමීටරයක් \u200b\u200bCa2 + අයන 20.04 mg / L හෝ Mg2 + අයන 12.16 mg / L අන්තර්ගතයට අනුරූප වේ.
එබැවින්, ගැටළු විසඳීමේදී, ඔබට සූත්රය භාවිතා කළ හැකිය:
(mmol - equal / l),
කොහෙද m - ජල දෘ ness තාව ඇති කරන හෝ ජල දෘ ness තාව තුරන් කිරීමට භාවිතා කරන ද්\u200dරව්\u200dයයේ ස්කන්ධය, mg;
මා- මෙම ද්\u200dරව්\u200dයයේ සමාන ස්කන්ධය, g / mol;
වී- ජල පරිමාව, l
දෘ ness තාව අනුව, සියලු ස්වාභාවික ජලය බෙදා ඇත මෘදුයි(සම්පූර්ණ දෘ ness තාව 2 mmol / l ට අඩු) සහ දැඩිසාමාන්\u200dය ff නකම (2-10 mmol / l) සහ ඉහළ තද බවක් (10 mmol / l ට වඩා වැඩි) සමඟ.
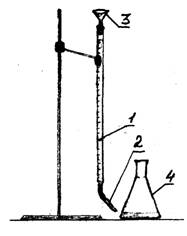
1 - බුරෙට්
2 - බිංදු
3 - පුනීලය
රූපය 1 - පර්යේෂණාත්මක සැකසුම
කාර්ය සාධන අත්දැකීම්
ෆ්ලැස්ක් තුනකින්, විශාල උපාධිධාරී සිලින්ඩරයකින් ජලය මිලි ලීටර් 100 ක් මැනීම. වතුර සමග එක් එක් නළයට මෙතිල් තැඹිලි දර්ශකයේ 2-3 බිංදු එකතු කරන්න. ටයිටරේෂන් 0.1 එන්. බුරෙට් භාවිතා කරමින් හයිඩ්\u200dරොක්ලෝරික් අම්ල ද්\u200dරාවණය. බුරෙට් හි ඇති අම්ල මට්ටම ශුන්\u200dය බෙදීමකට සකසන්න. ද්\u200dරාවණයේ වර්ණය කහ සිට තැඹිලි-රෝස දක්වා වෙනස් වන තුරු හයිඩ්\u200dරොක්ලෝරික් අම්ලය පහළට ඇද දමන්න. මාතෘකාවට ගිය අම්ල ප්\u200dරමාණය සටහන් කරන්න. මාතෘකාව තවත් දෙවරක් නැවත කරන්න. වගුවේ දත්ත ඇතුළත් කරන්න.
ගණනය කිරීම සූත්රය අනුව සිදු කරයි:
![]() (mmol - equal / l),
(mmol - equal / l),
හයිඩ්\u200dරොක්ලෝරික් අම්ලයේ සාමාන්\u200dය සාන්ද්\u200dරණය කොහිද;
Vcp ( Hcl) - සාමාන්\u200dය පරිමාව එච්.සී.එල් මාතෘකාව සඳහා ගොස්;
Vwater - මාතෘකාව සඳහා ගන්නා ජල පරිමාව.
අප ලබාගත් දත්ත වගුවක ස්වරූපයෙන් නිර්මාණය කර ඇත.
ජල නියැදිය
මාතෘකාව සඳහා භාවිතා කරයි
පෙරූ ජලය නම් කිරීම සඳහා භාවිතා කරයි
නළ ජලය - රසායන විද්\u200dයා කැබිනට්ටුව
නළයෙන් ජලය - ශා. ගුවන් සේවා
නළයෙන් ජලය - ශා. ඔක්තෝබර්
තීරුවෙන් ජලය - පි. වෙරළ
නළයෙන් ජලය - ශා. පොක්\u200dරොව්ස්කි
ළිඳෙන් ජලය - ශා. පොක්\u200dරොව්ස්කි
නළයෙන් ජලය - ශා. බෙල්ගොරොඩ්
නළයෙන් ජලය - ශා. සොල්දාදුවා
සෝඩා වතුර "ලස්සන"
පාසල් රසායනාගාරයේ කොන්දේසි යටතේ, දෘ hard තාව සඳහා විවිධ ප්\u200dරභවයන්ගෙන් ලබාගත් ජලය පිළිබඳව අපි අධ්\u200dයයනයක් සිදු කළෙමු. දෘ ness තාව තීරණය කිරීම සඳහා, මෙතිල් තැඹිලි දර්ශකයක් ඉදිරිපිට හයිඩ්\u200dරොක්ලෝරික් අම්ලය සමඟ ස්වාභාවික ජලය නම් කිරීම භාවිතා කරන ලදී. ජල සාම්පලයේ කාබනේට් දෘ ness තාව ගෘහස්ථ පෙරණයක් හරහා යැවීමට පෙර සහ පසුව තීරණය කරන ලදි (ඇක්වාෆෝර් භාවිතා කරන ලදි).
කාර්යයේ ප්\u200dරති result ලයක් ලෙස පහත සඳහන් නිගමනවලට එළඹුණි:
1) නොවි ඔස්කොල් නගරයේ ජලය දුෂ්කර ය (W \u003d 7-10.5). බොහෝ අය පෞද්ගලික අංශයේ ජීවත් වන අතර ළිංවලින් ජලය භාවිතා කරන අතර මෙම ජලය ඉතා දුෂ්කර ය.
2) ජල සැපයුමට ඇතුළු වන ජලය පිරිසිදු කිරීම හා මෘදු කිරීම (L \u003d 6-7) වලට භාජනය වේ, එබැවින් එය මධ්\u200dයම දෘ ness තාව ලෙස සැලකිය හැකිය (GOST අනුව, පානීය ජලයේ මුළු දෘ ness තාව 7 mmol / l ට වඩා වැඩි නොවිය යුතුය).
3) ජලය මෘදු කිරීම සඳහා ගෙදර හැදූ පහසුම ක්\u200dරමය සාම්ප්\u200dරදායිකව තාපාංකයයි.
4) අත්හදා බැලීම්වලින් හෙළි වී ඇත්තේ ගෘහස්ථ පෙරහන් ද ජලය මුළුමනින්ම මෘදු කරන බවයි. ඉතින්, උල් පිළිබඳ ළිඳෙන් පර්යේෂණ සඳහා ගත් ජලය. පොක්\u200dරොව්ස්කි (දෘ ness තාව 10.5 mmol / L), පෙරීමෙන් පසු, දෘඩතාව 2 mmol / L පමණක් වූ අතර එය භෞතික විද්\u200dයාත්මක සම්මතයට (3.5 mmol / L) වඩා අඩුය. මේ අනුව, ජල පෙරහන් යනු ඔබේ නිවසින් පිටව නොයා අසීමිත ප්\u200dරමාණවලින් පිරිසිදු ජලය ලබා ගැනීමට කදිම අවස්ථාවකි.
යොමු ලැයිස්තුව
1.,. සනීපාරක්ෂක පර්යේෂණ තාක්\u200dෂණය සමඟ ප්\u200dරායෝගික සනීපාරක්ෂක අභ්\u200dයාස සඳහා මාර්ගෝපදේශයකි. - එම් .: “වෛද්\u200dය විද්\u200dයාව”, 19s.
2. සහ. රසායනික විශ්ලේෂණයේ මූලධර්ම. සිසුන් සඳහා අධ්\u200dයයන මාර්ගෝපදේශය. - එම්: "en ානාලෝකය", 1971. - 192 පි.
3 .. අකාබනික රසායන විද්\u200dයාව: පෙළ පොත. තාක්ෂණවේදියෙකු සඳහා විශේෂ විශ්ව විද්\u200dයාල. - එම්: ඉහළ. පාසල., 1989 .-- 432 පි.
4.,. අපගේ නගරයේ පරිසරය අපි නිරීක්ෂණය කරමු: 9-11 ශ්\u200dරේණි: පාසල් වැඩමුළුව. - එම්: මනුෂ්\u200dයත්වය. සංස්. VLADOS මධ්\u200dයස්ථානය, 2001. - 112 පි.
5. රසායන විද්\u200dයාව: Ref. ed./V. ෂ්රෝටර්, කේ.එච්. ලෝටෙන්ෂ්ලෙගර්, එච්. බිබ්\u200dරැක් සහ වෙනත් අය: පර්. රසායන විද්\u200dයාව, 1989. - පර්. සංස්කරණය: ජීඩීආර්, 1986.- 648 පි.
පරිවර්තන දාම
1. කැල්සියම් කාබනේට් කැල්සියම් ඔක්සයිඩ් කැල්සියම් හයිඩ්\u200dරොක්සයිඩ් කැල්සියම් කාබනේට් කැල්සියම් නයිට්රේට්.
2. මැග්නීසියම් සල්ෆේට් මැග්නීසියම් නයිට්රේට් මැග්නීසියම් ඔක්සයිඩ් මැග්නීසියම් ඇසිටේට්.
3. කැල්සියම් ක්ලෝරයිඩ් කැල්සියම් සල්ෆේට් කැල්සියම් සල්ෆයිඩ් කැල්සියම් සල්ෆේට් කැල්සියම් හයිඩ්\u200dරොක්සයිඩ් කැල්සියම් ඔක්සයිඩ් කැල්සියම් හයිඩ්\u200dරොකාබනේට්.
4. මැග්නීසියම් මැග්නීසියම් ඔක්සයිඩ් මැග්නීසියම් හයිඩ්\u200dරොක්සයිඩ් මැග්නීසියම් ක්ලෝරයිඩ් මැග්නීසියම් හයිඩ්\u200dරොක්සොකාබනේට් මැග්නීසියම් සල්ෆේට් මැග්නීසියම් හයිඩ්\u200dරොක්සයිඩ්.
5. මැග්නීසියම් සල්ෆයිඩ් මැග්නීසියම් ඔක්සයිඩ් ... මැග්නීසියම් හයිඩ්\u200dරොක්සයිඩ් ... මැග්නීසියම් නයිට්රේට්.
6. කැල්සියම් කැල්සියම් හයිඩ්\u200dරොක්සයිඩ් කැල්සියම් කාබනේට් කැල්සියම් ඔක්සයිඩ් කැල්සියම් කාබයිඩ් කැල්සියම් හයිඩ්\u200dරොක්සයිඩ් කැල්සියම් හයිඩ්\u200dරොකාබනේට්.
බේරුම්කරණ කාර්යයන්
මට්ටම A
1. ජලය සමඟ ලෝහ ග්\u200dරෑම් 13.7 ක අන්තර්ක්\u200dරියා මගින් වායුව ලීටර් 2.24 ක් නිකුත් කරයි (n.a.). ලෝහය හඳුනා ගන්න. එහි ප්\u200dරති solution ලයක් වශයෙන් ලැබෙන ද්\u200dරාවණයට සෝඩියම් සල්ෆේට් අතිරික්තයක් එකතු කළ හොත් කුමන වර්ෂාපතනයක් සහ කුමන ප්\u200dරමාණයකින් සෑදී ඇත්ද?
විසඳුම
වායුව (H 2) ජලය සමඟ M Ia සහ IIa උප කාණ්ඩවල අන්තර්ක්\u200dරියා අතරතුර මුදා හරිනු ලැබේ.
සමාන නීතියට අනුව:
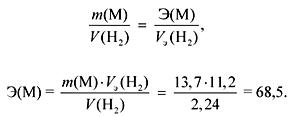
M Ia උප සමූහ නම්, එසේ නම්
ඒ r (එම්) \u003d ඊ සංයුජතාව \u003d 68.5 (එවැනි ලෝහයක් නොමැත).
M IIa උප සමූහ නම්, එසේ නම්
ඒ r (එම්) \u003d ඊ සංයුජතාව \u003d 137 (බා).
බා + 2 එච් 2 ඕ \u003d බා (ඕඑච්) 2 + එච් 2,
බා (OH) 2 + Na 2 SO 4 \u003d BaSO 4 + 2NaOH,
(BaSO 4) \u003d (Ba (OH) 2) \u003d (Ba) \u003d\u003d 0.1 mol,
m(බාසෝ 4) \u003d එම්\u003d 0.1 233 \u003d 23.3 ග්රෑම්.
පිළිතුර. ලෝහ - බා; m(බාසෝ 4) \u003d 23.3 ග්රෑම්.
2. අවසාදිත සෑදීම සම්පූර්ණ කිරීම සඳහා කැල්සියම් බයිකාබනේට් 10% ද්\u200dරාවණයක (ity නත්වය 1 g / cm 3) 81 g ට එකතු කළ යුතු 0.5 M කැල්සියම් හයිඩ්\u200dරොක්සයිඩ් ද්\u200dරාවණය කුමක්ද? අවසාදිතයේ ස්කන්ධය තීරණය කරන්න.
පිළිතුර. Ca (OH) 2 මිලි 100, CaCO 3 ග්\u200dරෑම් 10.
3. පොටෑසියම් සල්ෆේට් සහ ක්\u200dරෝමේට් මිශ්\u200dරණයක ග්\u200dරෑම් 23.3 ක් අඩංගු ද්\u200dරාවණයට බේරියම් ක්ලෝරයිඩ් අතිරික්තයක් බලපා ඇත. වර්ෂාපතනය පෙරීම, සේදීම, පසුව හයිඩ්\u200dරොක්ලෝරික් අම්ලය අතිරික්තයක් එයට එකතු කරන ලදී. වර්ෂාපතනයේ කොටසක් විසුරුවා හරින ලද අතර, ඉතිරි කොටස පෙරීම, සේදීම සහ වියළීම සිදු කරන ලදී. වියළීමෙන් පසු වර්ෂාපතනයේ ස්කන්ධය ග්රෑම් 23.3 ක් විය. ආරම්භක මිශ්\u200dරණයේ සංයුතිය තීරණය කරන්න.
පිළිතුර. K 2 SO 4 හි 17.4 ග්රෑම් සහ K 2 CrO 4 හි 5.9 ග්රෑම්.
4. 1: 3: 4 (ලැයිස්තුගත කිරීමේ අනුපිළිවෙල අනුව) සංරචකවල මවුලික අනුපාතය සහිත කැල්සියම්, කැල්සියම් ඔක්සයිඩ් සහ කැල්සියම් කාබයිඩ් මිශ්\u200dරණයක් ඇත. එවැනි මිශ්\u200dරණයක ග්\u200dරෑම් 35 ක් සමඟ රසායනික අන්තර්ක්\u200dරියා වලට ඇතුළු විය හැකි ජල පරිමාව කුමක්ද?
පිළිතුර. 17.568 මිලි.
5. 100 ° C දී ජලයේ ඇති ස්ට්\u200dරොන්ටියම් හයිඩ්\u200dරොක්සයිඩ්වල ද්\u200dරාව්\u200dයතාව ග්\u200dරෑම් 28 ක් වන අතර ජලය ග්\u200dරෑම් 100 කට 25 ° C - 1 ග්රෑම්. 100 ° C දී සංතෘප්ත වූ ස්ට්\u200dරොන්ටියම් හයිඩ්\u200dරොක්සයිඩ් ද්\u200dරාවණයක ග්\u200dරෑම් 200 ක් 25 ° C දක්වා සිසිල් කරන ලදී. ද්\u200dරාවණය සිසිල් කළ විට වේගවත් වූ ස්ට්\u200dරොන්ටියම් හයිඩ්\u200dරොක්සයිඩ් ඔක්ටහයිඩ්\u200dරේට් ස්කන්ධය සොයා ගන්න.
පිළිතුර. 93.08 g Sr (OH) 2 8H 2 O.
බී මට්ටම
1. වායු පරිණාමය නතර වන තුරු ස් cry ටිකරූපී මැග්නීසියම් කාබනේට් ස්කන්ධයක් ගණනය කරන ලදී. සාන්ද්\u200dරිත සල්ෆියුරික් අම්ලය සහ දෙහි ජලය සහිත ෆ්ලෑෂ් බෝතල් හරහා දෙවැන්න සම්මත විය. පළමු නළයේ ස්කන්ධය ග්\u200dරෑම් 1.8 කින් වැඩි වූ අතර දෙවන ග්\u200dරෑම් 2 ක වර්ෂාපතනය පහත වැටුණි. ආරම්භක ස් stal ටිකරූපී හයිඩ්\u200dරේටයේ සංයුතිය සහ එහි ස්කන්ධය තීරණය කරන්න.
පිළිතුර. MgCO 3 5H 2 O පෙන්ටහයිඩ්\u200dරේට්; 3.48 ග්රෑම්
2. ග්\u200dරෑම් 100 ක් බරැති මිශ්\u200dරණයක කාබනේට්, බයිකාබනේට් සහ කැල්සියම් නයිට්රේට් වල මවුලික අනුපාතය 1: 2: 3 (ලැයිස්තුගත කිරීමේ අනුපිළිවෙල අනුව) වේ. 1200 ° C දී ඇති පරිමාව සහ සාමාන්\u200dය පීඩනය මෙම මිශ්\u200dරණයේ වායුමය දිරාපත්වීමේ නිෂ්පාදන ගන්නේ කෙසේද?
විසඳුම
මිශ්රණයේ සං components ටකවල වියෝජන ප්රතික්රියා වල සමීකරණ:
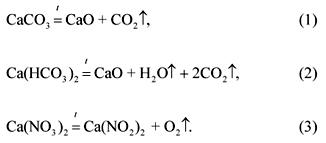
ගැටලුවේ තත්වය අනුව:
(CaCO 3): (Ca (HCO 3) 2): (Ca (NO 3) 2) \u003d 1: 2: 3.
ඉඩ දෙන්න (CaCO 3) \u003d x මවුලය.
එවිට (Ca (HCO 3) 2) \u003d 2 x;
(Ca (NO 3) 2) \u003d 3 x;
100x + 162 2x +164 3x \u003d100,
x 0.109 mol.
දී පි \u003d 101.3 kPa සහ ටී \u003d 1200 ° C වායුමය තත්වයක එය මුදා හරිනු ලැබේ:
CO 2 සමීකරණයට අනුව (1):
1 (CO 2) \u003d (CaCO 3) \u003d x \u003d 0.109 mol;
සමීකරණයට අනුව H 2 O, CO 2 (2):
2 (H 2 O) \u003d (Ca (HCO 3) 2) \u003d 2 x \u003d 0.218 mol,
2 (CO 2) \u003d 2 (Ca (HCO 3) 2) \u003d 4 x \u003d 0.436 mol;
O 2 සමීකරණයට අනුව (3):
3 (O 2) \u003d (Ca (NO 3) 2) \u003d 3 x \u003d 0.327 mol.
වායුමය දිරාපත්වීමේ නිෂ්පාදනවල මවුල ගණන:
0.109 + 0.218 + 0.436 + 0.327 \u003d 1.09 mol (n.a.).
පරිපූර්ණ වායූන්ගේ තත්ව සමීකරණයේ සිට අපට පරිමාව සොයාගත හැකිය:
pV = ආර්.ටී.,
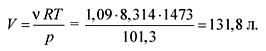
පිළිතුර. වී \u003d ලීටර් 131.8
3. ද්විමය ලෝහ හයිඩ්\u200dරොක්සයිඩ් සහ කාබනේට් සමාන ප්\u200dරමාණයේ මිශ්\u200dරණයක් ගණනය කරන ලදී. The න අපද්\u200dරව්\u200dයයේ ස්කන්ධය ආරම්භක මිශ්\u200dරණයේ ස්කන්ධයට වඩා 1.775 ගුණයකින් අඩු විය. මෙම අපද්\u200dරව්\u200dයයට 5% සල්ෆියුරික් අම්ල ද්\u200dරාවණයක 10 ගුණයක් විශාල ස්කන්ධයක් එකතු කරන ලදී. එහි ප්\u200dරති ing ලයක් ලෙස ලැබෙන ද්\u200dරාවණයේ ඇති ද්\u200dරව්\u200dයවල ස්කන්ධ කොටස ගණනය කරන්න.
පිළිතුර. 6% MgSO 4.
4. සමාන ස්කන්ධ භාගයක් සහිත ද්විභාෂා ලෝහයක හයිඩ්\u200dරයිඩ් හා නයිට්\u200dරයිඩ් මිශ්\u200dරණයකින් ජලය පිරිපහදු කළ විට 2.658 හයිඩ්\u200dරජන් ity නත්වයක් සහිත වායු මිශ්\u200dරණයක් සාදන ලදී. සංයෝගවලට ඇතුළත් කර ඇති ලෝහය සකසන්න (ගණනය කිරීමේදී සංඛ්\u200dයා වට නොකරන්න!).
පිළිතුර. කැල්සියම්
5. ග්\u200dරෑම් 16 ක් බරැති තඹ (II) සල්ෆේට් ද්\u200dරාවණයකට ග්\u200dරෑම් 16 ක මැග්නීසියම් තහඩුවක් දැමූ අතර තහඩුව ඉවත් කළ විට ද්\u200dරාවණයේ අඩංගු ලවණවල ස්කන්ධ භාගය සමාන විය. තහඩුවේ ස්කන්ධය කී වතාවක් වැඩි කළාද?
පිළිතුර. 4.5 වතාවක්.
ගුණාත්මක කාර්යයන්
1. මැග්නීසියම් හයිඩ්\u200dරොක්සයිඩ් සමඟ අන්තර්ක්\u200dරියා කරන මෙම ද්\u200dරව්\u200dය අතුරින්: හයිඩ්\u200dරොක්ලෝරික් අම්ලය, නයිට්\u200dරික් අම්ලය, කාබන් ඩයොක්සයිඩ්, සෝඩියම් ක්ලෝරයිඩ්, බේරියම් හයිඩ්\u200dරොක්සයිඩ්, සල්ෆියුරික් අම්ලය, තඹ (II) ඔක්සයිඩ්?
පිළිතුර. HCl, HNO 3, H 2 SO 4.
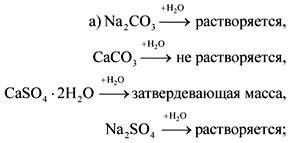
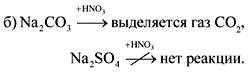
2. ලේබල් නොමැති බෝතල්වල සෝඩා, හුණු, ජිප්සම් සහ සෝඩියම් සල්ෆේට් ඇත. ජලය හා නයිට්\u200dරික් අම්ලය සමඟ මෙම ද්\u200dරව්\u200dය හඳුනාගත හැක්කේ කෙසේද?
පිළිතුර.
3. ද්\u200dරව්\u200dයය A යනු සැහැල්ලු තරමක් තද රිදී-සුදු ලෝහයකි. සරල වායුමය ද්\u200dරව්\u200dයයක් වන A සමඟ B ද්\u200dරව්\u200dයයේ අන්තර්ක්\u200dරියාකාරිත්වයේ දී C සංයෝගය සෑදී ඇති අතර එය ජලයේ ද්\u200dරාව්\u200dය වන අතර ක්ෂාරීය ද්\u200dරාවණයක් සාදයි. සල්ෆියුරික් අම්ලය සමඟ ලුණු සාදනු ලබන අතර, ස් stal ටිකරූපී හයිඩ්\u200dරේටය අස්ථි බිඳීම් සඳහා සවි කරන ඇඳුම් ඇඳීම සඳහා වෛද්\u200dය විද්\u200dයාවේ භාවිතා වේ. ප්\u200dරතික්\u200dරියා සමීකරණ දෙන්න.
පිළිතුර. A යනු Ca; බී යනු එච් 2; C යනු CaH 2; ස් stal ටිකරූපී හයිඩ්\u200dරේට් - CaSO 4 2H 2 O.
4. ද්\u200dරව්\u200dය A යනු ක්ෂාරීය ද්\u200dරාවණයක් සෑදීම සඳහා ජලයේ ද්\u200dරාව්\u200dය ඔක්සයිඩයකි. මෙම ද්\u200dරාවණයේ ඇති B සංයෝගය ගන්ධ රහිත වායුව C සමඟ ප්\u200dරතික්\u200dරියා කර සුදු ප්\u200dරපාතයක් සාදයි, එය වායුව C තව දුරටත් ගමන් කරන විට ක්\u200dරමයෙන් දිය වේ. ප්\u200dරතික්\u200dරියා සමීකරණ ලබා දී ද්\u200dරව්\u200dය හඳුනා ගන්න.
පිළිතුර. A යනු CaO, BaO; B යනු Ca (OH) 2, Ba (OH) 2; C යනු CO 2 වේ.
5. පෘථිවි පෘෂ් ust යේ ඇති වඩාත් සුලභ ඛනිජ වලින් එකක් වන ද්\u200dරව්\u200dයය A, අධික උෂ්ණත්වයේ දී ඔක්සයිඩ දෙකකට දිරාපත් වන අතර ඉන් එකක් B සෑම විටම ජීව ක්\u200dරියාවලියේදී සෑදී ඇත. බී ද්\u200dරව්\u200dයය මිනිරන් සමඟ අන්තර්ක්\u200dරියා කරන විට, රත් වූ විට, උණුසුම් ලේ සහිත සතුන්ට විෂ සහිත වායුව සී, ගිනි අවුලුවන, වර්ණ රහිත හා ගන්ධ රහිත ය. ප්\u200dරතික්\u200dරියා වල සමීකරණ දෙන්න, ද්\u200dරව්\u200dය හඳුනා ගන්න.
පිළිතුර. ඒ - කැකෝ 3; B යනු CO 2; C - CO.
ජල දෘ ness තාව සහ එය තුරන් කිරීම
රසායන විද්\u200dයාව සාරාංශය
තේමාව:“ජල දෘ ness තාව”
වැඩ කොන්ත්\u200dරාත්කරු:ග්\u200dරාබින් පාවෙල්.
සැලැස්ම
හැඳින්වීම 3
ජල දෘ ness තාව තීරණය කිරීම. 3
දැඩි කිරීමේ ක්\u200dරම 4
යොමුව 6
හැඳින්වීම
ගුහා වලදී, ගුහා වඩාත් සුන්දර හුණුගල් සැකැස්මක් සමඟ හමුවෙයි - ආරුක්කු වලින් එල්ලෙන ස්ටාලැක්ටයිට් සහ ඉහළට වැඩෙන ස්ටාලග්මයිට්. රසායන විද්\u200dයාවේ දෘෂ්ටි කෝණයෙන් බලන කල සොබාදහමේ මෙම විස්මිත නිර්මාණ බිහිවීම භූගත ජලයේ දෘඩතාවයි. ජල දෘ hard තාව පිළිබඳ සංකල්පය අපට හමුවන්නේ කථන විද්\u200dයාව හා භූ විද්\u200dයාව පමණක් නොව, පොදුවේ, සෑම තැනකම - රසායන විද්\u200dයාව, තාක්\u200dෂණය සහ එදිනෙදා ජීවිතයේදී පවා ය. එබැවින් ජලයේ ගුණාත්මකභාවය තීරණය කිරීම සඳහා මෙම සංකල්පය ඉතා වැදගත් වේ.
ජල දෘ ness තාව තීරණය කිරීම
ජල දෘ ness තාව - එහි ඇති ද්\u200dරාව්\u200dය කැල්සියම් සහ මැග්නීසියම් සංයෝගවල අන්තර්ගතයට සම්බන්ධ ජලයේ දේපල (සෝදා නොගත යුතුය, වාෂ්ප බොයිලේරු වල පරිමාණය ලබා දීම), මෙය ජලයේ ඇති කැල්සියම් සහ මැග්නීසියම් කැටායනවල අන්තර්ගතය පෙන්වන පරාමිතියකි.
දෘ ness තාව යනු ජලයේ විශේෂ ගුණාංග වන අතර එය බොහෝ දුරට එහි පාරිභෝගික ගුණාංග තීරණය කරන අතර එබැවින් වැදගත් ආර්ථික වටිනාකමක් ඇත. තාපන බොයිලේරු, බැටරි ආදියෙහි බිත්ති මත hard න ජලය සාදයි, එමඟින් ඒවායේ තාප ක්\u200dරියාකාරිත්වය සැලකිය යුතු ලෙස පිරිහී යයි. උෂ්නත්ව පෘෂ් on ය මත එවැනි තුනී ස්ථරයක් කිසිසේත් හානිකර නොවේ, මන්ද අඩු තාප සන්නායකතාවක් සහිත පරිමාණ තට්ටුවක් හරහා උනුසුම් වීමේ කාලය ක්\u200dරමයෙන් වැඩි වන අතර, පතුල වේගයෙන් හා වේගයෙන් දැවී යයි - සියල්ලට පසු, ලෝහය වඩාත් සෙමින් හා සෙමින් සිසිල් වන අතර, එය දිගු කාලයක් රත් වූ තත්වයේ පවතී. අවසානයේදී, යාත්රාවේ පතුල ඔරොත්තු නොදෙන අතර කාන්දු වීමට ඉඩ නොදේ. වාෂ්ප බොයිලේරු පවතින කර්මාන්තයේ මෙම කරුණ ඉතා භයානක ය.
සේදීම සඳහා hard න ජලය සුදුසු නොවේ. රෙදි සෝදන යන්ත්\u200dරවල තාපකවල පරිමාණය ඒවා පිළිවෙලට තබයි, එය සබන් සේදීමේ ගුණාංගද නරක අතට හැරේ. Ca 2+ සහ Mg 2+ කැටායන සබන් මේද අම්ල සමඟ ප්\u200dරතික්\u200dරියා කොට දුර්වල ලෙස ද්\u200dරාව්\u200dය ලවණ සාදයි, ඒවා චිත්\u200dරපට නිපදවන අතර ප්\u200dරපාතයට පත්වේ, අවසානයේදී සේදීමේ ගුණාත්මකභාවය අඩු කරන අතර ඩිටර්ජන්ට් පරිභෝජනය වැඩි කරයි, එනම්. hard න වතුර ඉණිම
තද බව වර්ග දෙකක් තිබේ: තාවකාලික හා ස්ථිර. මෙම වෙනසට හේතුව කැල්සියම් සහ මැග්නීසියම් වලට ප්\u200dරතිවිරුද්ධ ලෙස ද්\u200dරාවණයේ පවතින ඇනායන වර්ගයයි.
තාවකාලික දෘ ness තාව Ca 2+, Mg 2+ සහ Fe 2+ හයිඩ්\u200dරොකාබනේට් හෝ බයිකාබනේට් ඇනායන (HCO 3 -) කැටායන සමඟ ජලයේ පැවතීම සමඟ සම්බන්ධ වේ.
ස්ථිර තද බව (හෝ කාබනේට් නොවන) ද්\u200dරාවණය තුළ සල්ෆේට්, ක්ලෝරයිඩ්, නයිට්රේට් සහ වෙනත් ඇනායන තිබේ නම්, කැල්සියම් සහ මැග්නීසියම් ලවණ හොඳින් ද්\u200dරාව්\u200dය වන අතර ඒවා ඉවත් කළ නොහැක. සම්පූර්ණ දෘ ness තාව ද්\u200dරාවණයේ ඇති සියලුම කැල්සියම් සහ මැග්නීසියම් ලවණවල අන්තර්ගතය ලෙස අර්ථ දැක්වේ.
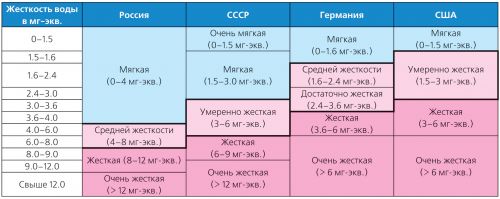
විවිධ රටවලට ජලය සඳහා ඔවුන්ගේම දෘ hard තාව පිළිබඳ ප්\u200dරමිතීන් ඇත. අපේ රටේ ජලය මේ ආකාරයෙන් දෘ hard තාව අනුව වර්ගීකරණය කර ඇත:
3.0 mEq / l ට අඩු දෘ hard තාව සහිත මෘදු ජලය,
මධ්යම දෘ ness තාව 3.0-6.0 mEq / L.
දෘ - - 6.0 mEq / ml ට වඩා.
තද බව ඉවත් කිරීමේ ක්\u200dරම.
තාවකාලික දෘ hard තාවයෙන් මිදීමට ඔබට ජලය තම්බා ගත යුතුය. ජලය උතුරන විට, බයිකාබනේට් ඇනායන කැටායන සමඟ ප්\u200dරතික්\u200dරියා කර ඉතා දුර්වල ලෙස ද්\u200dරාව්\u200dය කාබනේට් ලවණ සාදයි.
Ca 2 + 2HCO 3 - \u003d CaCO 3 ↓ + H 2 O + CO 2
යකඩ අයන සමඟ ප්\u200dරතික්\u200dරියාව වඩාත් සංකීර්ණ වන්නේ FeCO 3 ජලයේ අස්ථායී ද්\u200dරව්\u200dයයක් වීම හේතුවෙනි. ඔක්සිජන් ඉදිරිපිටදී, ප්\u200dරතික්\u200dරියා දාමයේ අවසාන නිෂ්පාදිතය Fe (OH) 3 වන අතර එය තද රතු ප්\u200dරපාතයකි. එමනිසා, ජලයේ වැඩි යකඩ, තාපාංකයේදී යාත්රාවේ බිත්ති සහ පතුලේ තැන්පත් වන පරිමාණයෙන් වර්ණය ශක්තිමත් වේ.
නිරන්තර තද ගතිය සටන් කිරීමට අපහසුය. එක් විකල්පයක්: අයිස් කැටි කිරීම. ඔබට අවශ්\u200dය වන්නේ ක්\u200dරමයෙන් ජලය කැටි කිරීමයි. ආරම්භක ප්\u200dරමාණයෙන් ද්\u200dරවයෙන් දළ වශයෙන් 10% ක් ඉතිරිව ඇති විට, ශීත කළ ජලය බැහැර කිරීම අවශ්\u200dය වන අතර අයිස් නැවත ජලයට හරවන්න. දෘඩතාවයක් ඇති කරන සියලුම ලවණ ශීත කළ ජලයේ නොපවතී.
ආහාර යනු එක් ක්\u200dරමයකි - ආසවනය, එනම් එහි පසු ens නීභවනය සමඟ ජලය වාෂ්ප වීම. ලවණ වාෂ්පශීලී නොවන සංයෝග බැවින් ඒවා පවතින අතර ජලය වාෂ්ප වී යයි.
නමුත් කැටි කිරීම සහ ආසවනය වැනි ක්\u200dරම සුදුසු වන්නේ ජලය කුඩා ප්\u200dරමාණයක් මෘදු කිරීම සඳහා පමණි. කර්මාන්තය ටොන් සමඟ ගනුදෙනු කරයි. එබැවින් වෙනත් ක්රම භාවිතා කරනු ලැබේ. විශේෂිත ප්\u200dරතික්\u200dරියාකාරක භාවිතා කිරීම මත පදනම්ව වඩාත් බහුලව භාවිතා වන කැටායන හුවමාරු ක්\u200dරමය - කැටායන හුවමාරුකාරක, ඒවා පෙරහන් තුළට පටවන අතර ඒවා හරහා ජලය සම්ප්\u200dරේෂණය වන විට කැල්සියම් සහ මැග්නීසියම් කැටායන සෝඩියම් කැටායනය මගින් ප්\u200dරතිස්ථාපනය කරයි.
රසායන විද්\u200dයාවේ දෘෂ්ටි කෝණයෙන් ජල පරිමාණයේ දෘ hard තාවයේ ප්\u200dරතිවිපාක සමඟ ඔබට ඉතා පහසුවෙන් සටන් කළ හැකිය. වඩා ශක්තිමත් අම්ලයක් සහිත දුර්වල අම්ලයක ලුණු වලට බලපෑම් කිරීම අවශ්ය වේ. දෙවැන්න ගල් අඟුරු තැනීම අස්ථායී වීම නිසා ජලය හා කාබන් ඩයොක්සයිඩ් බවට දිරාපත් වේ. පරිමාණයේ සංයුතියට සිලිකේට් සහ සල්ෆේට් සහ පොස්පේට් ඇතුළත් විය හැකිය. නමුත් ඔබ කාබනේට් "ඇටසැකිල්ල" විනාශ කළහොත් මෙම සංයෝග මතුපිට පවතින්නේ නැත.
ජලයට එකතු කරන ඇඩිපික් අම්ලය සහ මැලික් ඇන්හයිඩ්\u200dරයිඩ් ද අවලංගු කිරීමේ කාරක ලෙස භාවිතා කරයි. මෙම ද්\u200dරව්\u200dය සල්ෆමික් අම්ලයට වඩා දුර්වල බැවින් තාපාංකය ද බැහැර කිරීම අවශ්\u200dය වේ.
යොමුව:
Shpausus Z. රසායන විද්\u200dයාවේ ලෝකයට සංචාරය කිරීම - මොස්කව්: අධ්\u200dයාපනය, 1967. - 431s.
කර්ලම්පොවිච් ජී.ඩී. සහ තවත් බොහෝ පැති රසායන විද්\u200dයාව. - එම්: අධ්\u200dයාපනය, 1992.-159 පි.
කොම්චෙන්කෝ ජී.පී. රසායන විද්\u200dයාවේ පෙළ පොත - එම් .: නිව් වේව්, 1996. - 304 පි.
සමාන රචනා:
බහුඅවයවිකතාවන්ගේ තනුක ද්\u200dරාවණවල ගුණාංග අධ්\u200dයයනය කිරීම සාධක දෙකක් සැලකිල්ලට ගනී: ද්\u200dරාවණයේ සාර්ව අණු වල අනුකූලතාව සහ ඒවා ද්\u200dරාවණය කරන ද්\u200dරාව්\u200dය අණු වල දිශානති අනුපිළිවෙල, එය තාප ගතික පරාමිතීන් සහ ද්\u200dරාවණයේ ව්\u200dයුහය මගින් විනිශ්චය කරන ලදී.
පළමු හා දෙවන අදියරවල සමාන්තර-නිවැරදි අයනයිට් පෙරහන් වල අරමුණ සහ ව්\u200dයුහය, මිශ්\u200dර ක්\u200dරියාව. ප්\u200dරතිවිරුද්ධ අයනීකරණ තාක්ෂණයේ ලක්ෂණ. ජලය මෘදු කිරීමේ සෝඩියම්-කැටායනීය ක්\u200dරමය පිළිබඳ විස්තරය. ජලය අපවිත්\u200dර කිරීම සහ අපවිත්\u200dර වීම පිළිබඳ මූලධර්ම.
කැටායන හුවමාරු කරුවන් සහ ඒවායේ දේපල. සෝඩියම් කැටායනය මගින් ජලය මෘදු කිරීමේ ක්\u200dරියාවලිය. හයිඩ්\u200dරජන්-සෝඩියම්-කැටායන හුවමාරු ජල මෘදුකාරකය. කැල්ක්-කැටිනයිට් සහ අර්ධ කැටායනකරණ ක්\u200dරම. කැටායන හුවමාරු පෙරහන් සහ කැටායන හුවමාරු ස්ථාපනයන්හි සහායක උපාංග.
පෙන සහ මතුපිට යනු කුමක්ද? අදියර අතුරුමුහුණතේ වැදගත්ම ලක්ෂණය ලෙස මතුපිට ආතතිය. විවිධ වර්ගයේ පෘෂ් act වංශීන් සඳහා පෙණ නඟින හා පෙන ස්ථායිතාව කෙරෙහි ජල දෘ ness තාවයේ බලපෑම පිළිබඳ පර්යේෂණාත්මක අධ්\u200dයයන ක්\u200dරම.
ජලයේ ගුණාංග සහ එය මෘදු කිරීමේ ක්\u200dරම. තාප හා බලශක්ති කර්මාන්තයේ පරිභෝජනය කරන ජලයෙහි දෘ ness තාව සඳහා අවශ්\u200dයතා. සංකීර්ණමිතික ක්\u200dරමය භාවිතා කරමින් ජල දෘ ness තාව තීරණය කිරීමේ න්\u200dයායාත්මක පදනම් සහ ක්\u200dරම. නියැදීම, ප්\u200dරතික්\u200dරියාකාරක, අධිෂ් .ානය.
දැව තාප දිරාපත් වීමෙන් කාබන් නිපදවීම, ගල් අඟුරු මගින් ද්\u200dරාවිත ද්\u200dරව්\u200dය හා වායූන් අවශෝෂණය කර ගැනීම. ක්ෂාර සමඟ කාබන් ඩයොක්සයිඩ් අන්තර්ක්\u200dරියා කිරීම, කාබන් මොනොක්සයිඩ් නිෂ්පාදනය සහ එහි ගුණාංග අධ්\u200dයයනය කිරීම. කාබනේට් සහ බයිකාබනේට් වල ගුණාංග පිළිබඳ හුරුපුරුදු වීම.
පානීය ජලයේ ගුණාත්මකභාවය පිළිබඳ කොන්දේසි සහිත දර්ශක. ජලය, තඹ සහ ඊයම් අයනවල කාබනික ද්\u200dරව්\u200dය නිර්ණය කිරීම. ජල දෘ ness තාව තුරන් කිරීමේ ක්\u200dරම. ජලය පිරිසිදු කිරීමේ ක්\u200dරම. පොටෑසියම් සල්ෆේට් වැඩ කරන විසඳුමක් සකස් කිරීම. අර්ධ කැටි කිරීමෙන් ජලය පිරිසිදු කිරීම.
කැල්සියම් වල රසායනික ගුණ. දෘෂ්ටි විද්\u200dයාවේ පිරිසිදු කැල්සියම් කාබනේට්, ලෝහ විද්\u200dයාවේ හුණුගල් - ප්\u200dරවාහ ලෙස භාවිතා කිරීම. ජිප්සම් කැල්සියම් සල්ෆේට් ස් stal ටිකරූපී හයිඩ්\u200dරේටයක් ලෙස. ෆොස්ෆරයිට් සහ ඇපටයිට් වල ප්\u200dරධාන සං component ටකය ලෙස පොස්පරික් අම්ලයේ කැල්සියම් ලුණු.
කාබන් සංයෝගවල විවිධත්වය, ඒවායේ ස්වභාවය සහ යෙදුමෙහි ව්\u200dයාප්තිය. ඇලෝට්\u200dරොපික් වෙනස් කිරීම්. නිදහස් කාබන් පරමාණුවේ භෞතික ගුණාංග සහ ව්\u200dයුහය. කාබන් වල රසායනික ගුණාංග. කාබනේට් සහ බයිකාබනේට්. දියමන්ති සහ මිනිරන් වල ව්\u200dයුහය.
ලිතෝස්ෆියරයේ ලක්ෂණ, පෘථිවි පෘෂ් .යේ ඇති රසායනික මූලද්\u200dරව්\u200dය හා ඛනිජවල සංයුතිය. වායුගෝලයේ ජල ව්\u200dයුහයේ ව්\u200dයුහය, රසායනික සංයුතිය හා ක්\u200dරියාකාරිත්වය. ජෛවගෝලයේ සිදුවන කාබනික ද්\u200dරව්\u200dයවල ප්\u200dරභාසංශ්ලේෂණයේ ලක්ෂණ. ජෛව රසායනික ක්\u200dරියාවලීන් අධ්\u200dයයනය කිරීම.
උණුසුම හා ගෘහස්ථ උණු වතුර පද්ධතිවල අධික ජල දෘ ness තාව තාප හුවමාරු ක්\u200dරියාවලියට ly ණාත්මක ලෙස බලපායි. ඊට අමතරව දැඩි පානීය ජලය මිනිස් සෞඛ්\u200dයයට අහිතකර ය. විවිධ අරමුණු සඳහා ජලය සඳහා, විවිධ මෘදු කිරීමේ ක්රම භාවිතා කරනු ලැබේ.
ජලය මෘදු කිරීම යනු දෘ hard තාවයේ ලවණ ජලයෙන් ඉවත් කිරීමේ ක්\u200dරියාවලියයි. නමුත් ජල දෘ ness තාව යනු කුමක්ද සහ එය ඉවත් කළ යුත්තේ ඇයි?
ජල දෘ ness තාව පිළිබඳ සංකල්පය සාමාන්\u200dයයෙන් කැල්සියම් කැටායන (Ca 2+) හා අඩු වශයෙන් මැග්නීසියම් (Mg 2+) සමඟ සම්බන්ධ වේ. ඇත්ත වශයෙන්ම, සියලුම ද්විමය කැටායන එක් මට්ටමකට හෝ වෙනත් මට්ටමකට තදින් බලපායි. ඒවා ඇනායන සමඟ අන්තර්ක්\u200dරියා කරන අතර වේගවත් විය හැකි සංයෝග (දෘ hard තාව ලවණ) සාදයි.
යකඩ, මැන්ගනීස් සහ ස්ට්\u200dරොන්ටියම් වල ලවණ ද වේගවත් විය හැකි නමුත් ප්\u200dරායෝගිකව මෙම සියලු මූලද්\u200dරව්\u200dයයන් තද බව කෙරෙහි එතරම් කුඩා බලපෑමක් ඇති කරයි.
ඇලුමිනියම් (අල් 3+) සහ ෆෙරික් යකඩ (Fe 3+) ද දෘ hard තාව කෙරෙහි බලපායි, නමුත් ස්වාභාවික ජලයේ ඇති pH මට්ටම් වලදී ඒවායේ ද්\u200dරාව්\u200dයතාවය සහ ඒ අනුව දෘ hard තාව සඳහා “දායකත්වය” නොසැලකිය. ඒ හා සමානව, බේරියම් (බා 2+) හි නොවැදගත් බලපෑම සැලකිල්ලට නොගනී.
තද ගතිය
ජල දෘ ness තාව වර්ග කිහිපයක් තිබේ. සම්පූර්ණ දෘ ness තාව තීරණය වන්නේ කැල්සියම් සහ මැග්නීසියම් අයනවල සමස්ත සාන්ද්\u200dරණයෙනි. එය කාබනේට් (තාවකාලික) සහ කාබනේට් නොවන (ස්ථිර) තද බවේ එකතුවයි.
කාබනේට් දෘ ness තාව ඇති වන්නේ ජලයේ හයිඩ්\u200dරොකාබනේට් සහ කාබනේට් තිබීම නිසාය (pH\u003e 8.3 හි). Ca 2+, Mg 2+ සහ Fe 2+ හයිඩ්\u200dරොකාබනේට් හෝ බයිකාබනේට් ඇනායන (HCO 3-) සමඟ කැටායන සමඟ ජලයේ සිටීම තාවකාලික දෘ ness තාව මගින් සංලක්ෂිත වේ. මෙම වර්ගයේ දෘ ness තාව උතුරන වතුරෙන් සම්පූර්ණයෙන්ම පාහේ තුරන් වන අතර එය තාවකාලික දෘඩතාව ලෙස හැඳින්වේ. ජලය රත් වූ විට, හයිඩ්\u200dරොකාබනේට් දිරාපත් වී කාබනික් අම්ලය සෑදී කැල්සියම් කාබනේට්, මැග්නීසියම් හයිඩ්\u200dරොක්සයිඩ් සහ යකඩ වේගවත් කරයි.
කාබනේට් නොවන දෘ ness තාව ඇති වන්නේ ශක්තිමත් අම්ලවල (සල්ෆියුරික්, නයිට්\u200dරික්, හයිඩ්\u200dරොක්ලෝරික්) කැල්සියම් සහ මැග්නීසියම් ලවණ තිබීම නිසා වන අතර එය තාපාංකයෙන් ඉවත් නොකෙරේ, එබැවින් එයට නිරන්තර දෘඩතාවයේ නම ලැබී ඇත.
ඒකක
ලෝක භාවිතයේදී, තදබල ඒකක කිහිපයක් භාවිතා කරනු ලැබේ, ඒවා සියල්ලම එකිනෙකා සමඟ එක්තරා ආකාරයකින් සහසම්බන්ධ වේ.
දෘ ness තාව ඒකකය ජලයේ දෘ ness තාව ලෙස සලකනු ලබන අතර, එයින් 1 l හි Ca 2+ හෝ Mg 2+ ට සමාන 1 mmol අඩංගු වේ. දෘ hard තාවයේ එක් ඒකකයක් (1 mmol / L) කැල්සියම් අයනවල අන්තර්ගතයට 20.04 mg / L ට සමාන හෝ මැග්නීසියම් අයන 12.15 mg / L ට සමාන වේ. ජලයේ සම්පූර්ණ දෘ ness තාව (H) සූත්\u200dරයෙන් ගණනය කළ හැකිය:
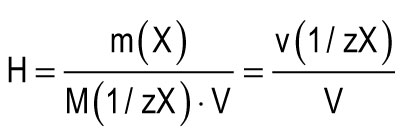
m (X) යනු ද්\u200dරාවිත ද්\u200dරව්\u200dයයේ ස්කන්ධය, mg; M (1 / zX) යනු ද්\u200dරව්\u200dයයට සමාන molar ස්කන්ධය, mg / mmol (g / mol); V යනු ජල පරිමාව, l; M (1 / zCa 2+) \u003d 20.04 mg / mmol; M (1 / zMg 2+) \u003d 12.15 mg / mmol.
මීට අමතරව, ජර්මානු උපාධිය (˚d, dH), ප්\u200dරංශ උපාධිය () f), ඇමරිකානු උපාධිය සහ ppm CaCO 3 වැනි තදබල ඒකක විදේශ රටවල බහුලව භාවිතා වේ.
මෙම තදබල ඒකකවල අනුපාතය වගුවේ දක්වා ඇත. 1.
වගුව 1. විවිධ of නත්වයේ අනුපාතය
ඉතින්, එක් ජර්මානු උපාධියක් ජලයේ 10 mg / dm 3 CaO හෝ 17.86 mg / dm 3 CaCO 3 ට අනුරූප වේ. එක් ප්\u200dරංශ උපාධියක් ජලයේ 10 mg / dm 3 CaCO 3 වන අතර ඇමරිකානු උපාධිය ජලයේ 1 mg / dm 3 CaCO 3 ට සමාන වේ.
ජල දෘ ness තාව පුළුල් ලෙස වෙනස් වන අතර විවිධ වර්ගීකරණයන් ඇත. එබැවින්, ජර්මනියේ, ප්\u200dරමිතිකරණය සඳහා වූ ජර්මානු ආයතනයේ (DIN 19643) දෘඩතාවයේ ප්\u200dරමිතීන් අදාළ වන අතර, ඇමරිකා එක්සත් ජනපදයේ - 1986 දී පරිසර ආරක්ෂණ ඒජන්සිය (USEPA) විසින් සම්මත කරන ලද වර්ගීකරණය (වගුව 2).
වගුව 2. විවිධ වර්ගවල තද ගතිය වර්ගීකරණය කිරීම
කුමන ජලය වඩා මෘදුද?
සාමාන්\u200dයයෙන්, අඩු ඛනිජ සහිත ජලයේ, කැල්සියම් අයන නිසා දෘ ness තාව ප්\u200dරමුඛ වේ (සමහර දුර්ලභ අවස්ථාවන්හිදී, මැග්නීසියම් දෘ ness තාව 50-60% දක්වා ළඟා විය හැක). ජලයෙහි සාමාන්\u200dය ඛනිජකරණයේ වැඩි වීමත් සමඟ කැල්සියම් අයනවල අන්තර්ගතය (Ca 2+) වේගයෙන් අඩු වන අතර කලාතුරකින් 1 g / l ඉක්මවයි. අධික ඛනිජ සහිත ජලයේ ඇති මැග්නීසියම් අයනවල (Mg 2+) අන්තර්ගතය ග්\u200dරෑම් කිහිපයකට ළඟා විය හැකි අතර, ලුණු විල් වල - ජලය ලීටරයකට ග්\u200dරෑම් දස දහස් ගණනකි.
පොදුවේ ගත් කල, මතුපිට ජල දෘ ness තාව සාමාන්\u200dයයෙන් භූගත ජල දෘඩතාවයට වඩා අඩුය. පෘෂ් water ීය ජලයේ දෘ ness තාව සැලකිය යුතු සෘතුමය උච්චාවචනයන්ට භාජනය වන අතර සාමාන්\u200dයයෙන් ශීත of තුව අවසානයේ එහි විශාලතම අගය කරා ළඟා වන අතර ගංවතුර කාලයේදී අවම අගයක් ගනී. එය මෘදු වැසි සහ දියවන ජලය සමග බහුල ලෙස තනුක කර ඇත. මුහුදු සහ සාගර ජලය ඉතා ඉහළ දෘඩතාවයක් ඇත (දස දහස් ගණනක් සහ මෙක් / ලී සිය ගණනක්).
තද ගතියේ ප්\u200dරතිවිපාක
මැග්නීසියම් රසය නිසා දැඩි පානීය ජලය කටුක වන අතර ආහාර ජීර්ණ පද්ධතියට අහිතකර ලෙස බලපායි. ලෝක සෞඛ්\u200dය සංවිධානයේ (WHO) ප්\u200dරමිතීන්ට අනුව පානීය ජලයේ ප්\u200dරශස්ත දෘ ness තාව 1.0-2.0 mEq / l වේ.
ආහාර ප්\u200dරෝටීන සහිත කැල්සියම් කැටායන දිය නොවන සංයෝග සාදන බැවින් ආහාර නිෂ්පාදන hard න ජලයේ දුර්වල ලෙස ජීර්ණය වේ; ඒවායේ පෝෂණ අගය අඩු වේ. Hard න ජලය නිරන්තරයෙන් භාවිතා කිරීම මිනිස් සිරුරේ ලවණ (යූරොලිතියාසිස්) තැන්පත් වීමට හේතු වේ.
තේ සහ කෝපි එවැනි ජලයේ දුර්වල ලෙස සාදනු ලැබේ. ගෘහස්ථ තත්වයන් තුළ, දෘඩ ලවණ අතිරික්තයක් බොයිලේරු, තේ පෝච්චි, පයිප්පවල තාපන පෘෂ් aces යන් පරිමාණයට ලක් කිරීම, ජලනල සවිකිරීම් මත ලවණ තැන්පත් වීම සහ ඒවා අසමත් වීම, පුද්ගලයෙකුගේ හිසකෙස් හා සම මත තැන්පතුවක් තබමින් ඔවුන්ගේ “දෘ ness තාව” පිළිබඳ අප්\u200dරසන්න සංවේදීතාවයක් ඇති කරයි.
විවිධ නිෂ්පාදන සකස් කිරීම සඳහා භාවිතා කරන ජලයේ දෘ ness තාව පැහැදිලිව නියාමනය කර ඇති අතර එය 0.1-0.2 mEq / l මට්ටමේ පවතී.
උනුසුම් බොයිලේරු, බැටරි ආදියෙහි බිත්ති මත hard න ජලය සාදයි, ඒවායේ තාප ක්\u200dරියාකාරිත්වය සැලකිය යුතු ලෙස අඩපණ කරයි, නල මාර්ගවල නිදහස් කොටස අඩු කරයි.
නල මාර්ග පරිමාණ තැන්පතු වලින් පිරී ඇති අතර ඒවායේ tivity ලදායිතාව කිහිප වතාවක් පහත වැටේ. එබැවින්, යම් ලුණු අන්තර්ගතයක් සහිත ජලය භාවිතා කිරීමට අවසර ඇති එම ක්\u200dරියාවලීන්හි දී, එහි දෘඩතාව ඊටත් වඩා අඩු අගයන්ට සීමා වේ - 0.03-0.05 mEq / l.
රෙදි සෝදන යන්ත්\u200dරවල තාපකවල පරිමාණය ඒවා පිළිවෙලට තබයි. රෙදි සෝදන විට, සබන් හෝ රෙදි සෝදන ඩිටර්ජන්ට් වල මතුපිට ක්\u200dරියාකාරී ද්\u200dරව්\u200dය (පෘෂ් act ීය ද්\u200dරව්\u200dය) සමඟ අන්තර්ක්\u200dරියා කරන විට දෘ hard තාව ලවණ ඒවා බන්ධනය වන අතර වැඩි පරිභෝජනයක් අවශ්\u200dය වේ. ඇතැම් තාක්ෂණික ක්\u200dරියාවලීන් සිදු කිරීමේදී hard න ජලය භාවිතා කළ නොහැක, නිදසුනක් ලෙස පින්තාරු කිරීමේදී, විද්\u200dයුත් රසායන විද්\u200dයාවේදී යනාදිය.
ලුණු ඉවත් කිරීම
ජල පිරිපහදු කිරීමේදී Ca 2+ සහ Mg 2+ ලවණ ජලයෙන් නිස්සාරණය කිරීමේ ක්\u200dරියාවලිය ජල මෘදු කිරීම ලෙස හැඳින්වේ.
සාපේක්ෂව තෝරාගත් ජලයෙන් දෘ hard තාව ලවණ ඉවත් කිරීම ක්\u200dරම මඟින් කළ හැකිය:
- තාප පිරියම් කිරීම;
- ආසවනය;
- ප්\u200dරතික්\u200dරියාකාරක මෘදු කිරීම;
- කැටි කිරීම;
- චුම්බක සැකසුම්;
- අතිධ්වනික සැකසුම්;
- අයන හුවමාරුව;
- ප්\u200dරතිලෝම ඔස්මෝසිස්.
ජල පිරිපහදු ක්\u200dරම ද හැඳින්වේ (විද්\u200dයුත් චුම්භක බලපෑම්, පොලිපොස්පේට් හෝ වෙනත් “පරිමාණ විරෝධී”), එමඟින් ටික කලක් දෘ hard තාවයේ ලවණ “බන්ධනය” කිරීමට ඉඩ සලසයි, ඒවා යම් කාලයක් සඳහා පරිමාණයේ ස්වරූපයෙන් වැටීම වළක්වයි. කෙසේ වෙතත්, මෙම ක්\u200dරම මගින් දෘ hard තාවයේ ලවණ රසායනිකව උදාසීන නොකරයි, ඇත්ත වශයෙන්ම ඒවා ඉවත් නොකරන්න, එබැවින් කාර්මික ජලය පිරිපහදු කිරීමේදී සීමිත භාවිතයක් සොයාගෙන ඇත.
තාප මෘදු කිරීම
මේ ආකාරයෙන්, ඔවුන් කැල්සියම් සහ මැග්නීසියම් බයිකාබනේට් නිසා ඇති වන තාවකාලික තද ගතියෙන් මිදෙයි. ජලය උතුරන විට, හයිඩ්\u200dරොකාබන දිරාපත් වන්නේ මධ්\u200dයම හෝ මූලික කාබනේට් වර්ෂාපතනයක් ඇති කිරීමට ය:
Ca (HCO 3) 2 \u003d CaCO 3 ↓ + CO 2 + H 2 O,
Mg (HCO 3) 2 \u003d Mg 2 (OH) 2 CO 3 ↓ + 3CO 2 + H 2 O.
එහි ප්\u200dරති water ලයක් ලෙස ජල දෘ ness තාව අඩු වේ. බයිකාබනේට් තද බව තාවකාලික ලෙස හඳුන්වන්නේ එබැවිනි.
යකඩ අයන සමඟ ප්\u200dරතික්\u200dරියාව වඩාත් සංකීර්ණ වන්නේ FeCO 3 ජලයේ අස්ථායී ද්\u200dරව්\u200dයයක් වීම හේතුවෙනි. ඔක්සිජන් ඉදිරිපිටදී, ප්\u200dරතික්\u200dරියා දාමයේ අවසාන නිෂ්පාදිතය Fe (OH) 3 වන අතර එය තද රතු ප්\u200dරපාතයකි. එමනිසා, ජලයේ වැඩි යකඩ, තාපාංකයේදී යාත්රාවේ බිත්ති සහ පතුලේ තැන්පත් වන පරිමාණයෙන් වර්ණය ශක්තිමත් වේ.
මේ අනුව, එදිනෙදා ජීවිතයේ ජලය උතුරන විට, එහි අර්ධ මෘදු කිරීමේ ක්රියාවලිය එකවර සිදු වේ.
ආසවනය
ආසවනය සාම්ප්\u200dරදායික, effective ලදායී හා විශ්වාසදායක ක්\u200dරමයක් වන අතර එය අධික ලවණතාවයකින් හා දෘඩතාවයකින් යුත් අධික සේලයින් ජලය පිරිසිදු කිරීම ඉහළ මට්ටමක පවතී.
මෙම ක්\u200dරමය මඟින් ජලය ලබා ගැනීමේ පොදු මූලධර්මය පහත පරිදි වේ: පෙර සූදානම් කළ පානීය ජලය ප්\u200dරධාන කොටස් තුනකින් සමන්විත ස්කාගාරයට ඇතුළු වේ: වාෂ්පකාරකය, කන්ඩෙන්සර් සහ එකතු කරන්නා.
ජලය සමග වාෂ්පකාරකය නභිගත වේ. ජල වාෂ්ප කන්ඩෙන්සර් තුළට ඇතුළු වන අතර එහිදී ඒවා ද්\u200dරව වී ඇති අතර ආසවනය ස්වරූපයෙන් එකතු කරන්නාට ඇතුල් වේ. ප්\u200dරභව ජලයේ ඇති සියලුම වාෂ්පශීලී නොවන අපද්\u200dරව්\u200dය ස්කාගාරයේ පවතී.
පිරිසිදු ජලය ලබා ගැනීම සඳහා, ඩිස්ටිලර් භාවිතා කරනු ලැබේ, ඒවා උණුසුම, tivity ලදායිතාව සහ සැලසුම් ලක්ෂණ අනුව එකිනෙකට වෙනස් වේ.
තනි ආසවනය කිරීමේ ක්\u200dරමය ආර්ථිකමය නොවන බැවින් එය භාවිතා කරන විට උණුසුම හා වාෂ්පීකරණය සඳහා අධික බලශක්ති පිරිවැයක් ඇත (වාෂ්ප කිලෝග්\u200dරෑමයකට 3000 kJ පමණ), මෙන්ම වාෂ්ප ens නීභවනය සඳහා ජල පරිභෝජනය (ජලය ලීටර් 8 ක් පමණ වාෂ්ප කිලෝග්\u200dරෑම් 1 ක්). එබැවින් අඩු ජල පරිභෝජනය සඳහා තනි ආසවනය භාවිතා කිරීම සුදුසුය - 10-20 l / h.
සාම්ප්\u200dරදායික ආසවනයට වඩා කාර්යක්ෂම හා ලාභදායී වන්නේ ඉහළ කාර්යසාධනයක් සහිත බහු තීරු ආසවනයයි. නමුත් ඒවා අතිශයින්ම මිල අධික වන අතර, ඊට අමතරව, ජලය සඳහා පූර්ව පිරිපහදු කිරීමේ පිරිවැය ඉහළ ය.
ආසවනය කිරීමේ ක්\u200dරමය මඟින් ප්\u200dරභව ජලයේ ඇති සියලුම ද්\u200dරාව්\u200dය ලවණ ඉවත් කරන බව සඳහන් කිරීම වටී.
ප්\u200dරතික්\u200dරියාකාරක යෙදුම
ජලය මෘදු කිරීම සඳහා සීමා කිරීම, සෝඩා-සීමා කිරීම සහ සෝඩා-සෝඩියම් ක්\u200dරමය මගින් ජලය මෘදු කිරීම සිදු වේ.
සීමා කරන විට, pH අගය 10 ක් පමණ ද්\u200dරාවණයට හයිඩ්\u200dරේටඩ් හුණු Ca (OH) 2 එකතු කරනු ලැබේ.
Ca (HCO 3) 2 + Ca (OH) 2 \u003d 2 CaCO 3 + 2H 2 O,
Mg (HCO 3) 2 + 2Ca (OH) 2 \u003d Mg (OH) 2 + 2СaCO 3 + 2Н 2 O.
එකවර දෘ hard තාව හා ක්ෂාරීයතාවයේ අඩුවීමක් අවශ්\u200dය වන විට මෙම ක්\u200dරමය ඉහළ කාබනේට් හා අඩු කාබනේට් නොවන දෘ hard තාව සඳහා යොදා ගනී. අවශේෂ ff නත්වය කාබනේට් නොවන .නතාවයට වඩා 0.4-0.8 mEq / L වැඩි වේ.
සෝඩා දෙහි එකතු කළ විට, ස්ලැක් දෙහි Ca (OH) 2 සහ සෝඩා Na 2 CO 3 pH අගය 10 ක් පමණ ජලයට එකතු වේ. එහි ප්\u200dරති as ලයක් ලෙස පහත සඳහන් ප්\u200dරතික්\u200dරියා සිදු වේ:
Ca (HCO 3) 2 + Ca (OH) 2 + Na 2 CO 3 \u003d 2 CaCO 3 + 2NaOH + H 2 CO 3,
Mg (HCO 3) 2 + 2NaOH \u003d Mg (OH) 2 + 2NaHCO 3.
ප්\u200dරතික්\u200dරියා සමීකරණ වලින් පහත දැක්වෙන පරිදි, ජලයෙන් අවසාදිත සෑදීම හා අවසාදිත කිරීමේ ක්\u200dරියාවලියේදී දෘ hard තාව ලවණ නිස්සාරණය කරනු ලැබේ. ඒවා සමඟ, ආශ්\u200dරිත දූෂණය සමඟ කොලොයිඩල් සහ අත්හිටවූ අංශු ඉවත් කරනු ලැබේ. කාබනික අවසාදිතය අවසාදිත පිටි මත අර්ධ වශයෙන් ගිලී ඇත.
එච්.සී.ඕ 3 අයන අතිරික්තය නිසා සෝඩා සීමා කිරීමත් සමඟ ජලයෙන් දෘ hard තාවයේ ලවණ ඉවත් කිරීමේ සම්පූර්ණත්වය ලබා ගත හැකිය. උෂ්ණත්වය 70-80 to C දක්වා ඉහළ නැංවීම මඟින් අවශේෂ තද බව 0.35-1.0 mEq / L දක්වා ගෙන ඒමට ඔබට ඉඩ සලසයි. ප්\u200dරතික්\u200dරියාකාරක මාත්\u200dරාව වැඩි කිරීමෙන් එකම ප්\u200dරති result ලය ලබා ගත හැකිය.
සෝඩා සෝඩා ක්\u200dරමය
කාබනේට් නොවන දෘ ness තාව කාබනේට් වලට වඩා වැඩි නම් සෝඩා එකතු කිරීම අවශ්\u200dය වේ. මෙම පරාමිතීන් සමාන නම්, සෝඩා එකතු කිරීම කිසිසේත් අවශ්\u200dය නොවනු ඇත.
ක්ෂාර සමඟ ප්\u200dරතික්\u200dරියා කරන කැල්සියම් සහ මැග්නීසියම් හයිඩ්\u200dරොකාබනේට් දුර්වල ලෙස ද්\u200dරාව්\u200dය කැල්සියම් සහ මැග්නීසියම්, සෝඩා, ජලය සහ කාබන් ඩයොක්සයිඩ් සංයෝග සාදයි:
Ca (HCO 3) 2 + 2NaOH \u003d CaCO 3 ↓ + Na 2 CO 3 + 2H 2 O,
Mg (HCO 3) 2 + 2NaOH \u003d Mg (OH) 2 ↓ + Na 2 CO 3 + H 2 O + CO 2.
ක්ෂාර සමග මැග්නීසියම් හයිඩ්\u200dරජන් කාබනේට් ප්\u200dරතික්\u200dරියා කිරීමේ ප්\u200dරති form ලයක් ලෙස ඇති වූ කාබන් ඩයොක්සයිඩ් නැවත ක්ෂාර සමඟ ප්\u200dරතික්\u200dරියා කොට සෝඩා සහ ජලය සාදයි:
CO 2 + NaOH \u003d Na 2 CO 3 + H 2 O.
කාබනේට් නොවන දෘ ness තාව
සල්ෆේට් සහ කැල්සියම් ක්ලෝරයිඩ් කාබනේට් දෘ ness තාව හා ක්ෂාරීය ප්\u200dරතික්\u200dරියා වලදී සාදන ලද සෝඩා සමඟ ප්\u200dරතික්\u200dරියා කරන අතර සෝඩා එකතු කර ක්ෂාරීය තත්වයන්ට නොගැලපෙන කැල්සියම් කාබනේට් සාදයි:
CaCl 2 + Na 2 CO 3 \u003d CaCO 3 ↓ + 2NaCl,
CaSO 4 + Na 2 CO 3 \u003d CaCO 3 ↓ + Na 2 SO 4.
මැග්නීසියම් සල්ෆේට් සහ ක්ලෝරයිඩ් ක්ෂාර සමග ප්\u200dරතික්\u200dරියා කොට මැග්නීසියම් හයිඩ්\u200dරොක්සයිඩ් වේගවත් කරයි:
MgSO 4 + 2NaOH \u003d Mg (OH) 2 ↓ + Na 2 SO 4,
MgCl 2 + 2NaOH \u003d Mg (OH) 2 ↓ + 2NaCl.
ක්ෂාර සමග බයිකාබනේට් ප්\u200dරතික්\u200dරියා කිරීමේදී සෝඩා සෑදී ඇති අතර පසුව එය කාබනේට් නොවන දෘ ness තාව සමඟ ප්\u200dරතික්\u200dරියා කරයි. එහි ප්\u200dරමාණය කාබනේට් (එල්එෆ්ඒ) සහ කාබනේට් නොවන (එල්එෆ්ඒ) දෘ ness තාවයේ අනුපාතයට සහසම්බන්ධ විය යුතුය:
- ඒවා සමාන නම්, සෝඩා ඉවත් කළ හැකිය;
- lc\u003e Lnc යන කොන්දේසිය යටතේ සෝඩා අතිරික්තයක් සෑදී ඇත;
- lCD අනුපාතය සමඟ< Жнк - недостаток соды и ее необходимо добавлять.
තැන්පත් කිරීමේ ක්\u200dරියාවලිය අත්හිටුවන ලද අවසාදිත තට්ටුවක් සහිත අවසාදිත ටැංකි සහ පැහැදිලි කිරීම් වල සිදු කෙරේ.
අවසාදිත ටැංකි අකාර්යක්ෂම වන අතර ඒවායින් ලබා ගන්නා හයිඩ්\u200dරොක්සයිඩ් පල්ප් 97-99% ක ඉහළ ආර්ද්\u200dරතාවයක් ඇත. එබැවින් ඒවා දැනට ප්\u200dරායෝගිකව භාවිතා නොවේ.
ප්රායෝගිකව, අත්හිටවූ අවසාදිත තට්ටුවක් සහිත පැහැදිලි කිරීමේ විවිධ අනුවාදයන් භාවිතා වේ. ඒවා තුළ, පිරිසිදු කළ යුතු විසඳුම පහළින් සපයනු ලබන අතර අවසාදිත ස්ථරය හරහා ගමන් කරයි. මෙය ජල පිරිසිදු කිරීමේ සංගුණකය වැඩි කරයි.
පානීය ජලය සැකසීමේදී ප්\u200dරතික්\u200dරියාකාරක ක්\u200dරම භාවිතා නොකෙරේ. ඒවාට පසු, ජලය දැඩි ක්ෂාරීය ප්රතික්රියාවක් ඇත. එබැවින් යාන්ත්\u200dරික පෙරහන් පිරිසිදු කිරීමේ පළමු අදියර ලෙස ප්\u200dරතික්\u200dරියාකාරක බලශක්ති හා කර්මාන්තයේ බහුලව භාවිතා වේ. එකට වැඩ කරන විට, ජලය මෘදු කිරීමට, කොලොයිඩ් ඇතුළු අත්හිටවූ ids න ද්\u200dරව්\u200dය ඉවත් කිරීමට සහ කාබනික ද්\u200dරව්\u200dයවලින් ජලය අර්ධ වශයෙන් පිරිසිදු කිරීමට ඒවා ඔබට ඉඩ සලසයි.
කැටි කිරීම
ජලයේ නිරන්තර දෘ ness තාවයට එරෙහිව සටන් කිරීම සඳහා අයිස් කැටි කිරීම වැනි ක්\u200dරමයක් භාවිතා කරයි. මෙය සිදු කිරීම සඳහා, ඔබ ක්\u200dරමයෙන් ජලය කැටි කළ යුතුය. ආරම්භක ප්\u200dරමාණයෙන් දළ වශයෙන් 10% ක් ඉතිරිව ඇති විට, ශීත කළ නොවන ජලය බැස යාම අවශ්\u200dය වන අතර අයිස් නැවත ජලයට හරවන්න. දෘ ness තාව ඇති කරන සියලුම ලවණ ශීත කළ ජලයේ පවතී.
ආසවනය සමඟ, අධික සේලයින් ජලය පානීය ගුණාත්මකභාවයට අපවිත්\u200dර කිරීමේ එක් ක්\u200dරමයකි.
වෙනත් ක්\u200dරම
විද්\u200dයුත් විච්ඡේදක ක්\u200dරමය පදනම් වී ඇත්තේ සෘජු ධාරා ජාලයකට සම්බන්ධ ඉලෙක්ට්\u200dරෝඩ වෙත විද්\u200dයුත් විච්ඡේදක අයන සෘජුවම චලනය වීමේ සංසිද්ධිය මත ය. මේ අනුව, ජලයේ දෘ ness තාව තීරණය කරන ලෝහ අයන ඉලෙක්ට්\u200dරෝඩවල සිරවී ඇති අතර ජල පිරිපහදු යන්ත්\u200dරයෙන් පිටවන ජලයෙන් වෙන් කරනු ලැබේ.
චුම්බක අයනීකරණ ක්\u200dරමය අයනවල සෘජු චලනයේ සංසිද්ධිය ද භාවිතා කරයි, නමුත් දැනටමත් චුම්බක ක්ෂේත්\u200dරයක බලපෑම යටතේ ය. ජලයේ ඇති අයන සංඛ්\u200dයාව වැඩි කිරීම සඳහා එය මූලික වශයෙන් අයනීකරණ විකිරණ සමඟ ප්\u200dරකිරණය වේ.
ජලයේ චුම්බක ප්\u200dරතිකාරය සමන්විත වන්නේ ප්\u200dරතිවිරුද්ධ දිශාවන්හි චුම්බක ක්ෂේත්\u200dර පද්ධතියක් හරහා ජලය ගමන් කිරීමෙනි. මෙහි ප්\u200dරති result ලයක් ලෙස, විසුරුවා හරින ලද ද්\u200dරව්\u200dයවල සජලීකරණයේ අඩුවීමක් දක්නට ලැබෙන අතර ඒවායේ සංයෝගය විශාල අංශු බවට පත්වේ.
ජලය සඳහා අතිධ්වනික ප්\u200dරතිකාර මගින් අවසාදිත සෑදීමත් සමඟ විසුරුවා හරින ලද ද්\u200dරව්\u200dයවල විශාල අංශු සෑදේ.
ලිපියේ දෙවන කොටසේ අයන හුවමාරු ක්\u200dරමය සහ ප්\u200dරතිලෝම ඔස්මෝසිස් ක්\u200dරියාවලීන් විස්තරාත්මකව සලකා බැලීම සුදුසුය. එය ඊළඟ කලාපයේ අපගේ සඟරාවේ ප්\u200dරකාශයට පත් කෙරේ.
