Η σκληρότητα του νερού και η εξάλειψή του. Καθήκοντα και ασκήσεις για μέταλλα της υποομάδας iA
Σελίδα 1
Η εξάλειψη της προσωρινής σκληρότητας πραγματοποιείται με βραστό νερό. Μετά την βρασμό, καταστρέφονται τα υδρογονάνθρακες και τα κακώς διαλυτά ανθρακικά σχηματίζουν ίζημα. Όταν ανθρακικό νάτριο εισάγεται υδροξείδιο του ασβεστίου στο νερό, αφαιρείται η συνολική σκληρότητα του νερού. Σε αυτή την περίπτωση, η ανθρακική σκληρότητα απομακρύνεται με ασβέστη και η μη ανθρακική σκληρότητα απομακρύνεται με σόδα.
Εκτός από την εξάλειψη της προσωρινής σκληρότητας, ο ασβέστος καθιζάνει όλο το μαγνήσιο και το σίδηρο από το νερό και προωθεί την πήξη οργανικών και ανόργανων κολλοειδών.
Μετά τον καθαρισμό των ακαθαρσιών, εξαλείφοντας την προσωρινή σκληρότητα και την απαερίωση, τροφοδοτείται νερό μέσα στο εναλλάκτη θερμότητας (2), όπου θερμαίνεται στα 335 Κ. Μετά την ανάμιξη, το νερό παρασκευής και επιστροφής αντλείται στη δεύτερη ζώνη του εναλλάκτη θερμότητας (2) δίκτυα θέρμανσης.
Το μαλάκωμα χρησιμοποιείται συχνά για την εξάλειψη της προσωρινής σκληρότητας του νερού, σχεδιασμένο για να αντισταθμίζει τις απώλειες (επαναφόρτιση) στα κλειστά συστήματα παροχής κυκλοφοριακού νερού και για να εμποδίζει τις ομβικές μεταβολές των επιφανειών ανταλλαγής θερμότητας και ψύξης σε επαφή με κυκλοφορούντα ύδατα. Σε πολλές περιπτώσεις, το μακιγιάζ είναι η κύρια πηγή συσσώρευσης ιόντων ασβεστίου και βιοανθρακικών στα κυκλοφορούντα ύδατα, τα οποία σε συστήματα με υψηλούς συντελεστές εξάτμισης μπορούν να διαταράξουν τη σταθερή σύνθεση του κυκλοφορούντος νερού.
Το μαλακτικό νερό για την εξάλειψη της προσωρινής σκληρότητας διεξάγεται χημικά με την εισαγωγή αντιδραστηρίων, τα οποία χρησιμοποιούνται ως ασβέστιο, θειικό ή υδροχλωρικό οξύ. Οι χημικές μέθοδοι επιτυγχάνουν σχετικά ρηχό μαλάκωμα του νερού. Για υψηλότερο βαθμό μαλάκυνσης, χρησιμοποιούνται μέθοδοι ανταλλαγής κατιόντων, η ουσία των οποίων είναι η χρησιμοποίηση της ικανότητας ορισμένων ουσιών να ανταλλάσσουν κατιόντα του νατρίου που περιέχονται σε αυτά για κατιόντα των αλάτων σκληρότητας στο νερό.
Η καυστική σόδα χρησιμοποιείται σε θερμοηλεκτρικούς σταθμούς για την εξάλειψη της προσωρινής σκληρότητας του νερού, για την αναγέννηση των αναβολικών φίλτρων που χρησιμοποιούνται στα φυτά για τη χημική αφαλάτωση του νερού.
Η καυστική σόδα χρησιμοποιείται σε θερμοηλεκτρικούς σταθμούς για την εξάλειψη της προσωρινής σκληρότητας του νερού και την αναγέννηση ανιοντικών φίλτρων που χρησιμοποιούνται σε εγκαταστάσεις χημικής αφαλάτωσης.
Παρομοίως, η ποσότητα του Ca (OH) 2 που απαιτείται για την εξάλειψη της προσωρινής ακαμψίας θα πρέπει επίσης να υπολογιστεί.
Γιατί, για να εξαλειφθεί η προσωρινή ακαμψία λόγω των αλάτων μαγνησίου, απαιτείται περισσότερος ασβέστης από το να εξαλειφθεί η προσωρινή ακαμψία λόγω των αλάτων ασβεστίου.
Ως εκ τούτου, για να επαναφορτίσετε τα κλειστά (χωρίς καθαρισμό) συστήματα παροχής ύδατος, θα πρέπει να πραγματοποιηθεί σχετικά βαθιά μαλάκυνση του νερού μακιγιάζ και απομάκρυνση της προσωρινής σκληρότητας.
Η εισαγωγή μικρών ποσοτήτων αλκαλικών αντιδραστηρίων αυξάνει την αποτελεσματικότητα της μαγνητικής επεξεργασίας του νερού, αν και η εισαγωγή αλκαλικών αντιδραστηρίων, π.χ. ασβέστη σε ποσότητες που δεν υπερβαίνουν το 10-20% αυτών που είναι απαραίτητες για την εξάλειψη της προσωρινής ακαμψίας, σύμφωνα με μελέτες που διεξήχθησαν στο KhIEI το 1959, 8 έως 10 φορές.
Σε αυτή την περίπτωση, εξαντλείται το νερό των έξι οστών που προκαλείται από διττανθρακικά άλατα. Επομένως, αυτή η δυσκαμψία ονομάζεται προσωρινή ή διττανθρακική. Ως εκ τούτου, για την εξάλειψη της προσωρινής ακαμψίας, αρκεί να βράσει νερό.
Τα άλατα σταθερής σκληρότητας, για παράδειγμα, CaCl, CaS04, κλπ., Δεν απομακρύνονται από το νερό όταν θερμαίνονται. Καταβυθίζονται κατά την εξάτμιση του νερού, σχηματίζοντας στα τοιχώματα της συσκευής δύσκολη απομάκρυνση της πυκνής κλίμακας. Το σκληρό νερό μπορεί να χρησιμοποιηθεί μόνο στις περιπτώσεις όπου οι συνθήκες χρήσης του δεν προκαλούν καθίζηση στερεών ιζημάτων, για παράδειγμα σε ψυγεία όπου το νερό ψύξης δεν θερμαίνεται σε θερμοκρασία που βοηθά στην εξάλειψη της προσωρινής σκληρότητας. Στα λέβητα, όπου το νερό όχι μόνο θερμαίνεται αλλά και εξατμίζεται, δεν είναι μόνο απαράδεκτη η προσωρινή αλλά και η σταθερή σκληρότητα. Ως εκ τούτου, το νερό για αυτά καθαρίζεται προκαταρκτικά από άλατα ασβεστίου και μαγνησίου με χημική μέθοδο σε ειδικά φυτά.
Δημοτικό εκπαιδευτικό ίδρυμα
"Αριθμός δευτεροβάθμιας εκπαίδευσης 1
με σε βάθος μελέτη των επιμέρους θεμάτων
Διεύθυνση: Περιφέρεια Belgorod,
Δοκιμή σκληρότητας νερού
και τρόπους για την εξάλειψή της
φοιτητής 11 "A" τάξη MOU "Μέσος όρος
αριθμός δευτεροβάθμιας εκπαίδευσης 1
με σε βάθος μελέτη
μεμονωμένα στοιχεία
Διεύθυνση: Περιφέρεια Belgorod,
Επιστημονικός σύμβουλος :,
καθηγητής χημείας
αριθμός δευτεροβάθμιας εκπαίδευσης 1
με σε βάθος μελέτη
μεμονωμένα στοιχεία
novy Oskol, περιοχή Belgorod
Διεύθυνση: Περιφέρεια Belgorod,
novy Oskol,
novy Oskol
1. Εισαγωγή ................................................................................. .3
2. Σκληρότητα νερού και μέθοδοι εξάλειψής του ................................. .4
· Γιατί γίνεται σκληρό νερό .............................................................. 4
· Η αξία της σκληρότητας του νερού στην ανθρώπινη ζωή ............................................. 4
· Τρόποι εξάλειψης της δυσκαμψίας ............................................. ... 5
3. Η μελέτη της σκληρότητας του νερού και των μεθόδων για την εξάλειψή του .............. ... 8
4. Συμπεράσματα και συμπεράσματα
5. Κατάλογος αναφορών
Εισαγωγή
Ποιος μελέτησε τις επιστήμες, αλλά δεν τις εφαρμόζει,
παρόμοια με εκείνη που όργωσε, αλλά δεν σπείρει.
Saadi
Στη δεκαετία του '80 του 20ου αιώνα, τα βιβλία του Paul Chappius Bragg εμφανίστηκαν για την προώθηση ενός υγιεινού τρόπου ζωής. Και παρόλο που πολλοί λόγιοι θεωρούν τη γνώμη του αμφιλεγόμενη, τα βιβλία του Paul Bragg αξίζουν προσοχής. Ένα από τα τμήματα του βιβλίου του (τα πρώτα μου πειράματα με σκληρότητα) είναι αφιερωμένο στο πρόβλημα της σκληρότητας του νερού, όπου ο συγγραφέας στα απομνημονεύματά του περιγράφει την ασθένεια του παππού του, ο οποίος πέθανε από το γεγονός ότι τα αιμοφόρα αγγεία του απολιπαρώθηκαν από το σκληρό νερό και τη γυναίκα που ζούσε στα μέρη τους η ατυχής γυναίκα ονομάστηκε πέτρινη γυναίκα, αφού το σώμα της απολιπαρώθηκε κυριολεκτικά από μεγάλο αριθμό αλάτων). Η γυναίκα αυτή ήταν ένα από τα πολλά θύματα σκληρού νερού. Τα ατυχή όργανα απέτυχαν να αντιμετωπίσουν την επεξεργασία μιας μεγάλης ποσότητας ανόργανων ουσιών που περιέχονται σε ένα τέτοιο νερό και άρχισαν να συσσωρεύονται πολύ ενεργά στο σώμα της.
Οι ενώσεις ασβεστίου κατακρημνίζονται στο σώμα μας με τη μορφή πέτρων στα νεφρά και της χοληδόχου κύστης.
Σήμερα, η επεξεργασία του νερού δεν είναι μια ιδιοτροπία και περιποίηση, αλλά μάλλον μια ζωτική ανάγκη. Το γεγονός είναι ότι τέτοια δυσάρεστα φαινόμενα όπως τα απομεινάρια, οι τρίχες, οι μυρωδιές τρίτων, καθώς και η παρουσία ενός νεφελώδους ιζήματος προκαλούν όχι μόνο πολλές ενοχλήσεις αλλά προκαλούν και πολλές ασθένειες. Το νερό χαμηλής ποιότητας προάγει την εναπόθεση αλάτων, επιταχύνει τη διαδικασία γήρανσης του σώματος και προκαλεί χρόνιες ασθένειες. Επιπλέον, το χλώριο περιέχει μια σειρά ουσιών που μπορούν να προκαλέσουν καρκίνο. Αλλά το νερό είναι η βάση όλων των ζωών και κανένας ζωντανός οργανισμός δεν μπορεί να κάνει χωρίς νερό. Για παράδειγμα, ένα άτομο αποτελείται από νερό στο 60-65%. Ως εκ τούτου, το καθαρό νερό είναι ζωτικής σημασίας για κάθε άτομο. Δυστυχώς, το φυσικό νερό στην εποχή μας είναι εντελώς ακατάλληλο για κατανάλωση χωρίς προκαταρκτική επεξεργασία, κάτι που επιβεβαιώνεται από διάφορες αναλύσεις νερού. Όλοι γνωρίζουν ότι οι σταθμοί φιλτραρίσματος, οι οποίοι υποτίθεται ότι διεξάγουν καθαρισμό του νερού, χρειάζονται από καιρό μεγάλες επισκευές και τα συστήματα ύδρευσης μέσω των οποίων διανέμεται νερό στα σπίτια μας απαιτούν αντικατάσταση.
Στόχος της εργασίας μας ήταν να μελετήσουμε το επίπεδο σκληρότητας του νερού στη γενέτειρά μας.
Σκληρότητα νερού και μέθοδοι εξάλειψής της
Γιατί το νερό γίνεται σκληρό
Το ασβέστιο και οι ενώσεις του είναι πολύ απαραίτητες για το σώμα. Εξάλλου, από το ορθοφωσφορικό ασβέστιο Ca3 (P04) 2 συντίθενται τα οστά και τα δόντια των ανθρώπων και των ζώων. Δημιουργούνται από διαλυτές ενώσεις ασβεστίου, οι οποίες μεταφέρουν αίμα σε όλο το σώμα. Χάρη στα κατιόντα ασβεστίου Ca2 +, το αίμα είναι ικανό να πήξει, να σχηματίσει θρόμβους, να φράξει τα τραύματα και να σταματήσει την αιμορραγία.
Οι ενώσεις ασβεστίου δεν είναι μόνο χρήσιμες, αλλά και πολύ επιβλαβείς - για παράδειγμα, όταν δίνουν σκληρότητα στο συνηθισμένο νερό. Στην καθημερινή ζωή, η λέξη "ακαμψία", με την πρώτη ματιά, μπορεί να εφαρμοστεί μόνο σε στερεά: ένας πάγκος πάρκου ή ένα σκαμνί στην κουζίνα μπορεί να είναι στερεό. Ωστόσο, το νερό είναι επίσης σκληρό.
Η κύρια πηγή αλάτων μαγνησίου και ασβεστίου που εισέρχονται στο νερό είναι οι αποθέσεις ασβεστόλιθου, γύψου και δολομιτών που διαβρώνονται από φυσικά νερά.
Σε ύδατα με χαμηλή περιεκτικότητα σε αλατόνερο, τα περισσότερα από όλα τα ιόντα ασβεστίου. Με την αύξηση του βαθμού ανοργανοποίησης, η περιεκτικότητα σε ιόντα ασβεστίου μειώνεται ταχέως και σπανίως υπερβαίνει το 1 g / l. Η περιεκτικότητα σε ιόντα μαγνησίου στα μεταλλικά νερά μπορεί να φτάσει σε λίγα γραμμάρια και σε αλμυρά νερά αρκετές δεκάδες γραμμάρια.
Δύναμη νερού - ένας συνδυασμός χημικών και φυσικών ιδιοτήτων του νερού που σχετίζονται με την περιεκτικότητα σε διαλελυμένα άλατα αλκαλικών γαιών σε αυτό, κυρίως ασβέστιο και μαγνήσιο. Το νερό με υψηλή περιεκτικότητα σε τέτοια άλατα ονομάζεται σκληρό νερό, με χαμηλό περιεχόμενο - μαλακό. Υπάρχει προσωρινή δυσκαμψία (ανθρακικό) που σχηματίζεται από υδρογονάνθρακες και μόνιμη ακαμψία (μη ανθρακικά) που προκαλείται από την παρουσία άλλων αλάτων. Η προσωρινή δυσκαμψία οφείλεται στην παρουσία δισανθρακικών ασβεστίου και μαγνησίου (Ca (HCO3) 2, Mg (HCO3) 2) σε νερό. Η σταθερή σκληρότητα του νερού οφείλεται στην παρουσία στο νερό θειικών αλάτων, χλωριούχων αλάτων Ca και Mg (CaSO4, CaCl2, MgSO4, MgCl2).
Η αξία της σκληρότητας του νερού στην ανθρώπινη ζωή
Η σκληρότητα του νερού είναι το άθροισμα των ιόντων ασβεστίου Ca2 + και μαγνησίου Mg2 + διαλελυμένα σε νερό.
Τα ιόντα ασβεστίου και μαγνησίου δεν προκαλούν μεγάλη βλάβη στους ζώντες οργανισμούς, αλλά η παρουσία τους σε νερό σε μεγάλες ποσότητες είναι ανεπιθύμητη, δεδομένου ότι το νερό αυτό είναι ακατάλληλο για οικιακές ανάγκες.
Σε σκληρό νερό, η κατανάλωση σαπουνιού και σκόνης αυξάνεται όταν πλένετε τα ρούχα, το κρέας και τα λαχανικά χωνεύονται αργά και η κινητικότητα του στομάχου μειώνεται. Το σκληρό νερό είναι ακατάλληλο για συστήματα ύδρευσης και εξοπλισμό θέρμανσης νερού.
Η σκληρότητα μετράται σε χιλιοστόγραμμα ισοδύναμο ανά λίτρο (mEq / L). Τα βιομηχανικά πρότυπα για τις επιτρεπόμενες τιμές δυσκαμψίας εξαρτώνται από τον τύπο του χρησιμοποιούμενου εξοπλισμού. Συνήθως, λαμβάνεται υπόψη σκληρό νερό με σκληρότητα 1 mEq / L ή περισσότερο.
Η σκληρότητα είναι το πιο κοινό πρόβλημα ποιότητας του νερού. Αρχικά, ο όρος "σκληρό νερό" εφαρμόστηκε σε νερό που ήταν δύσκολο να πλυθεί.
Το σκληρό νερό, όταν πλένεται, στεγνώνει το δέρμα, ο αφρός σχηματίζεται ελάχιστα σε αυτό όταν χρησιμοποιεί σαπούνι. Η χρήση σκληρού νερού προκαλεί σχηματισμό ιζήματος (κλίμακας) στα τοιχώματα των λεβήτων, στους σωλήνες κλπ. Ταυτόχρονα, η χρήση πολύ μαλακού νερού μπορεί να οδηγήσει σε διάβρωση των σωλήνων, αφού στην περίπτωση αυτή δεν υπάρχει ρυθμιστικό διάλυμα βάσης οξέος που παρέχεται από υδρογονάνθρακες (προσωρινή) ακαμψία. Η κατανάλωση σκληρού ή μαλακού νερού συνήθως δεν είναι επικίνδυνο για την υγεία, αν και υπάρχουν ενδείξεις ότι η υψηλή ακαμψία συμβάλλει στον σχηματισμό των λιθωδών σταγόνων και χαμηλά - ελαφρά αυξάνει τον κίνδυνο καρδιαγγειακών παθήσεων.
Η σκληρότητα των φυσικών υδάτων μπορεί να ποικίλει αρκετά και είναι ασταθής καθ 'όλη τη διάρκεια του έτους. Η σκληρότητα αυξάνεται λόγω της εξάτμισης του νερού, μειώνεται κατά τη διάρκεια της βροχερής περιόδου, καθώς και κατά τη διάρκεια της τήξης του χιονιού και του πάγου.
Τρόποι για την εξάλειψη της δυσκαμψίας
Ξεχωρίστε συνολικά ακαμψία, η οποία αποτελείται από προσωρινή και σταθερή.
Βράζει.
Προσωρινή η ακαμψία (αναλώσιμη ή ανθρακική) οφείλεται στην παρουσία Ca (HCO3) 2 και Mg (HCO3) 2 δισανθρακικών σε νερό. Η σκληρότητα του άνθρακα είναι εύκολο να αφαιρεθεί βραστό νερόστην οποία τα Ca2 + και Mg2 + αφαιρούνται για να σχηματίσουν αδιάλυτα ιζήματα:
Ca (HCO3) 2 CaC03 ↓ + CO2 + Η2Ο
Τα ιόντα Mg καθιζάνουν με τη μορφή βασικού ανθρακικού άλατος ή με τη μορφή υδροξειδίου του μαγνησίου (σε pH\u003e 10,3).
2Mg2 + + ΟΗ) 2CO3 ↓ + CO2 + Η2Ο
(Σχηματίζονται ιόντα ΟΗ λόγω της αλληλεπίδρασης ιόντων με νερό: και η ισορροπία μετατοπίζεται προς τα δεξιά όταν θερμαίνεται).
Για τη μείωση της σκληρότητας ανθρακικών αλάτων μέθοδος ασβέστωσης στην οποία εισάγεται το επεξεργασμένο νερό ασβέστουCa (ΟΗ) 2. Οι αντιδράσεις που εμφανίζονται με την εισαγωγή του ασβέστη μπορούν να γραφτούν σε μοριακή μορφή:
Ca (HCO3) 2 + Ca (OH) 2 → 2CaCO3 ↓ + Η2Ο
Mg (HCO3) 2 + Ca (OH) 2 - Mg (ΟΗ) 2 ↓ + 2CaCO3 + Η2Ο
Η σταθερή σκληρότητα (μη ανακτήσιμη ή μη ανθρακική) διατηρείται όταν βράζει το νερό, επειδή η σταθερή σκληρότητα οφείλεται στην παρουσία στο νερό θειικών αλάτων, χλωριδίων και άλλων αλάτων Ca και Mg. Ποσοτικά, είναι ίση με τη συγκέντρωση ιόντων Ca2 + και Mg2 + μείον τη σκληρότητα του χρόνου. Συνήθως χρησιμοποιείται για τη μείωση της σκληρότητας ανθρακικών αλάτων. πυρωμένο σόδα (Na2C03):
MgS04 + Na2C03 - MgCO3 ↓ + Na2S04
Κατά την προσθήκη ασβέστου και σόδα μπορείτε να απαλλαγείτε από την ανθρακική και τη μη ανθρακική σκληρότητα ( άσβεστος-μεθόδου σόδας).
Όλη η ακαμψία εξαλείφεται ακόμη και με εισαγωγή φωσφορικό νάτριο, τετραβορικό νάτριο και άλλα. Επειδή τα ορθοφωσφορικά είναι λιγότερο διαλυτά από τα ανθρακικά, η χρήση τους στην αποσκλήρυνση του νερού είναι πιο βολική:
3CaS04 + 2Na3P04 → Ca3 (PO4) 2 ↓ + 3Na2S04
Ο σύγχρονος τρόπος μαλακώματος νερού βασίζεται χρησιμοποιώντας ρητίνες ανταλλαγής ιόντων - ιοντοανταλλάκτες (κατιονανταλλάκτες και ανιονανταλλάκτες). Οι κατιονανταλλάκτες είναι συνθετικές ιονανταλλακτικές ρητίνες - αργιλοπυριτικά, για παράδειγμα:
Η σύνθεσή τους μπορεί να εκφραστεί υπό όρους με τον γενικό τύπο Na2R, όπου το Na + είναι ένα πολύ κινητό κατιόν και το R είναι ένα σωματίδιο εναλλάκτη κατιόντων που φέρει ένα αρνητικό φορτίο.
Όταν το σκληρό νερό ρέει διαμέσου ενός στρώματος κατιοντοανταλλακτικής ρητίνης, τα κατιόντα ανταλλάσσονται σύμφωνα με τις αντιδράσεις:
Ca2 + + Na2R → 2Na + + CaR
Mg2 + + + Na2R → 2Na + + MgR
Έτσι, ιόντα Ca2 + και Mg2 + περνούν από το διάλυμα σε ρητίνη ανταλλαγής κατιόντων. Για την αποκατάσταση της ρητίνης ανταλλαγής κατιόντων, πλένεται με ένα πυκνό διάλυμα NaCl:
CaR + 2NaCl → CaCl2 + Na2R
Μετά το πλύσιμο, η ρητίνη ανταλλαγής κατιόντων μπορεί να χρησιμοποιηθεί και πάλι για να απομακρύνει την ακαμψία από το νερό.
Αντίστροφη όσμωση. Η μέθοδος βασίζεται στη διέλευση του νερού μέσω ημιπερατών μεμβρανών (συνήθως πολυαμιδίου). Μαζί με τα άλατα σκληρότητας, τα περισσότερα άλλα άλατα αφαιρούνται επίσης. Η απόδοση καθαρισμού μπορεί να φτάσει το 99,9%. Αυτή η μέθοδος έχει βρει τη μεγαλύτερη εφαρμογή στα οικιακά συστήματα επεξεργασίας πόσιμου νερού. Ως μειονέκτημα αυτής της μεθόδου, πρέπει να σημειωθεί η ανάγκη για προκαταρκτική παρασκευή νερού που τροφοδοτείται στην μεμβράνη αντίστροφης όσμωσης.
Ηλεκτροδιάλυση Βασίζεται στην αφαίρεση αλάτων από το νερό από τη δράση ενός ηλεκτρικού πεδίου. Η απομάκρυνση των ιόντων διαλυμένων ουσιών συμβαίνει λόγω ειδικών μεμβρανών. Όπως και με την τεχνολογία αντίστροφης όσμωσης, απομακρύνονται και άλλα άλατα, εκτός από τα ιόντα σκληρότητας.
Θερμική μέθοδος. Με βάση τη θέρμανση νερού, εξαλείφεται μόνο η προσωρινή (ανθρακική) ακαμψία. Βρίσκει εφαρμογή στην καθημερινή ζωή. Στη βιομηχανία χρησιμοποιείται, για παράδειγμα, σε θερμοηλεκτρικούς σταθμούς.
Μαλακτικό αντιδραστηρίου. Η μέθοδος βασίζεται στην προσθήκη σόδας ή σβέσης ασβέστη στο νερό. Σε αυτή την περίπτωση, άλατα ασβεστίου και μαγνησίου περνούν σε αδιάλυτες ενώσεις και ως αποτέλεσμα, καθιζάνουν. Αυτή η μέθοδος δικαιολογείται σε σχετικά υψηλή κατανάλωση νερού, επειδή συνδέεται με την επίλυση ορισμένων ειδικών προβλημάτων: διήθηση ιζήματος, ακριβής δοσολογία του αντιδραστηρίου.
Κατιοντοποίηση. Η μέθοδος βασίζεται στη χρήση κοκκώδους φορτίου ιοντοανταλλαγής (συνηθέστερα ρητίνες ανταλλαγής ιόντων). Μια τέτοια επαφή, κατά την επαφή με το νερό, απορροφά κατιόντα από άλατα σκληρότητας (ασβέστιο και μαγνήσιο). Σε αντάλλαγμα, ανάλογα με την ιοντική μορφή, δίνοντας μακριά ιόντα νατρίου ή υδρογόνου. Αυτές οι μέθοδοι ονομάζονται αντιστοίχως Na-κατιόν και Η-κατιόν. Κατά κανόνα, η σκληρότητα του ύδατος μειώνεται με κατιονισμό νατρίου ενός σταδίου σε 0,05-0,1 mEq / L, με δύο σταδίων - σε 0,01 mEq / L.
Καλύτερο αντιδραστήριο Για την εξάλειψη της γενικής σκληρότητας του νερού, το ορφωσφορικό νάτριο είναι Na3PO4: 3Ca (HCO3) 2 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 6NaHCO3 3MgSO4 + 2Na3PO4 → Mg3 (PO4) 2 ↓ + 3Na2SO4 Τα ορθοφωσφορικά ασβέστιο και μαγνήσιο είναι ελάχιστα διαλυτά στο νερό καλύτερη αποσκλήρυνση του νερού. Στη βιομηχανία, χρησιμοποιώντας φίλτρα ανταλλαγής ιόντων, τα ιόντα ασβεστίου και μαγνησίου αντικαθίστανται από ιόντα νατρίου και καλίου για την παραγωγή μαλακού νερού. Ένα ορισμένο μαλάκωμα του νερού συμβαίνει στα οικιακά φίλτρα για πόσιμο νερό. Το φιλτραρισμένο νερό δίνει μικρότερη κλίμακα. Το νερό μπορεί να καθαριστεί πλήρως με απόσταξη (απόσταξη).
Σήμερα υπάρχουν εξαιρετικά φίλτρα νερού τα οποία είναι εγκατεστημένα στο διαμέρισμα χωρίς προβλήματα και χρησιμεύουν ως ένα εξαιρετικό εργαλείο για την επεξεργασία νερού υψηλής ποιότητας. Ίσως πολλοί σήμερα προτιμούν να αγοράζουν εμφιαλωμένο καθαρό νερό σε σούπερ μάρκετ. Η επιλογή αυτού του νερού είναι πραγματικά τεράστια, αλλά είναι δυνατόν να είμαστε 100% σίγουροι για την ποιότητά του; Ίσως όχι! Αυτός είναι ο λόγος για τον οποίο ο καθαρισμός του νερού με τη βοήθεια ειδικά σχεδιασμένων φίλτρων καθαρισμού είναι η βέλτιστη λύση για ένα σύγχρονο άτομο που νοιάζεται για την υγεία του και την υγεία των αγαπημένων του. Τα συστήματα καθαρισμού του νερού είναι πολύ διαφορετικά. Κατά κανόνα, διαφέρουν: η απόδοση, ορισμένες παράμετροι, ο βαθμός καθαρισμού του νερού, καθώς και ο σχεδιασμός. Το νερό φιλτράρει τέλεια καθαρό νερό και το καθιστά κατάλληλο για πόση, μειώνει την περιεκτικότητα σε αλουμίνιο, σίδηρο, μαγγάνιο, χλώριο, όλα τα είδη νιτρικών αλάτων. Επιπλέον, τα φίλτρα καθαρισμού νερού βοηθούν στην εξάλειψη της δυσάρεστης οσμής, της γεύσης, καθώς και στην απαλλαγή από τα μικρόβια και τα βακτηρίδια που περιέχονται στο νερό. Το νερό που έχει καθαριστεί μέσω τέτοιων συστημάτων γίνεται λιγότερο άκαμπτο, ωστόσο, δεν χάνει χρήσιμες ουσίες απαραίτητες για το ανθρώπινο σώμα. Τα φίλτρα νερού είναι μια εξαιρετική ευκαιρία να λαμβάνετε καθαρό νερό σε απεριόριστες ποσότητες χωρίς να αφήσετε το σπίτι σας. Ένα σωστά επιλεγμένο φίλτρο θα είναι μια εξαιρετική λύση στο πρόβλημα του καθαρού νερού, θα βελτιώσει την υγεία και θα διευρύνει τη μακροζωία σας.
Μελέτη της σκληρότητας του νερού και μεθόδους για την εξάλειψή του
Η σκληρότητα του νερού οφείλεται στην παρουσία ιόντων Ca2 + και Mg2 +. Όσο υψηλότερη είναι η περιεκτικότητά τους σε φυσικό νερό (νερό που διέρχεται από ασβεστολιθικά πετρώματα και εδάφη), τόσο μεγαλύτερη είναι η σκληρότητα του.
Ποσοτικά, η σκληρότητα του νερού εκφράζεται ως το άθροισμα των χιλιοστοϊσοδύναμων ιόντων Ca2 + και Mg2 + που περιέχονται σε ένα λίτρο νερού (meq / l). Ένα χιλιοστοϊσοδύναμο σκληρότητας αντιστοιχεί σε περιεκτικότητα 20.04 mg / L ιόντων Ca2 + ή 12.16 mg / L ιόντων Mg2 +.
Επομένως, κατά την επίλυση προβλημάτων, μπορείτε να χρησιμοποιήσετε τον τύπο:
(mmol - ισοδ. / λ.),
όπου m - η μάζα της ουσίας που καθιστά τη σκληρότητα του νερού ή χρησιμοποιείται για την εξάλειψη της σκληρότητας του νερού, mg.
Μα- ισοδύναμη μάζα της ουσίας αυτής, g / mol,
V- όγκος νερού, l
Με τη σκληρότητα, όλα τα φυσικά νερά χωρίζονται σε μαλακό(συνολική σκληρότητα μικρότερη από 2 mmol / l) και σκληρήμε μέσο βαθμό ακαμψίας (2-10 mmol / l) και υψηλό βαθμό δυσκαμψίας (περισσότερο από 10 mmol / l).
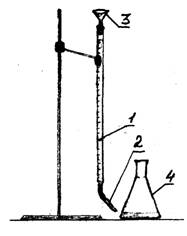
1 - προχοΐδα
2 - σταγονόμετρο
3 - χοάνη
Εικόνα 1 - Πειραματική ρύθμιση
Εμπειρία απόδοσης
Σε τρεις φιάλες, μετράτε με ένα μεγάλο κύλινδρο βαθμονομημένο 100 ml νερού. Προσθέστε 2-3 σταγόνες δείκτη πορτοκαλί μεθύλ σε κάθε φιάλη με νερό. Η τιτλοδότηση πραγματοποιείται 0,1 Ν. διαλύματος υδροχλωρικού οξέος χρησιμοποιώντας μια προχοΐδα. Ρυθμίστε το επίπεδο οξύτητας στη διουρία σε μηδενική διαίρεση. Χύστε το υδροχλωρικό οξύ στάγδην έως ότου το χρώμα του διαλύματος αλλάξει από κίτρινο σε πορτοκαλί-ροζ. Καταγράψτε την ποσότητα του οξέος που πήγε στην τιτλοδότηση. Επαναλάβετε την τιτλοδότηση δύο φορές. Καταχωρίστε τα δεδομένα στον πίνακα.
Ο υπολογισμός γίνεται σύμφωνα με τον τύπο:
![]() (mmol - ισοδ. / λ.),
(mmol - ισοδ. / λ.),
όπου είναι η κανονική συγκέντρωση υδροχλωρικού οξέος ·
Vcp ( Hcl) - μέσος όγκος ΗΟΙ πήγαν για τιτλοδότηση.
Vwater - ο όγκος του νερού που λαμβάνεται για την τιτλοδότηση.
Τα δεδομένα που έχουμε σχεδιάσει με τη μορφή πίνακα.
Δείγμα νερού
χρησιμοποιείται για τιτλοδότηση
που χρησιμοποιείται για την τιτλοδότηση διηθημένου νερού
Νερό βρύσης - γραφείο χημείας
Νερό από τη βρύση - st. Αεροπορία
Νερό από τη βρύση - st. Οκτώβριο
Νερό από τη στήλη - σελ. Παράκτια
Νερό από τη βρύση - st. Pokrovsky
Νερό από το καλοκαίρι. Pokrovsky
Νερό από τη βρύση - st. Belgorod
Νερό από τη βρύση - st. Στρατιώτης
Σόδα νερό "Όμορφη"
Στις συνθήκες του σχολικού εργαστηρίου, διεξήγαμε μια μελέτη για το νερό που ελήφθη από διάφορες πηγές για σκληρότητα. Για να προσδιοριστεί η σκληρότητα, χρησιμοποιήθηκε τιτλοδότηση του φυσικού ύδατος με υδροχλωρικό οξύ παρουσία δείκτη πορτοκαλιού μεθυλίου. Η ανθρακική σκληρότητα του δείγματος ύδατος προσδιορίστηκε πριν και μετά τη διέλευσή του από ένα οικιακό φίλτρο (χρησιμοποιήθηκε Aquaphor).
Ως αποτέλεσμα των εργασιών, έγιναν τα ακόλουθα συμπεράσματα:
1) Το νερό στην πόλη Novy Oskol είναι δύσκολο (W \u003d 7-10,5). Πολλοί άνθρωποι ζουν στον ιδιωτικό τομέα και χρησιμοποιούν νερό από πηγάδια, και αυτό το νερό είναι πολύ σκληρό.
2) Το νερό που εισέρχεται στην παροχή νερού υποβάλλεται σε καθαρισμό και μαλάκυνση (L \u003d 6-7), επομένως μπορεί να θεωρηθεί μέτρια σκληρότητα (σύμφωνα με την GOST, η συνολική σκληρότητα του πόσιμου νερού δεν πρέπει να είναι μεγαλύτερη από 7 mmol / l).
3) Ο πιο εύκολος τρόπος να μαλακώσετε το νερό είναι παραδοσιακά βρασμένος.
4) Τα πειράματα έχουν δείξει ότι τα φίλτρα των νοικοκυριών επίσης μαλακώνουν τέλεια το νερό. Έτσι, το νερό που ελήφθη για έρευνα από το πηγάδι στην ul. Το Pokrovsky (σκληρότητα 10,5 mmol / L), μετά από φιλτράρισμα, είχε σκληρότητα μόνο 2 mmol / L, η οποία είναι ακόμη χαμηλότερη από το φυσιολογικό πρότυπο (3,5 mmol / L). Έτσι, τα φίλτρα νερού είναι μια εξαιρετική ευκαιρία να λάβετε καθαρό νερό σε απεριόριστες ποσότητες χωρίς να αφήσετε το σπίτι σας.
Κατάλογος αναφορών
1,. οδηγός πρακτικών ασκήσεων υγιεινής με την τεχνική της υγειονομικής έρευνας. - M .: "Ιατρική", 19ετών.
2. και. Βασικές αρχές χημικής ανάλυσης. Οδηγός σπουδών για φοιτητές. - Μ.: "Διαφωτισμός", 1971. - 192 σελ.
3 .. Ανόργανη χημεία: Εγχειρίδιο. για τεχνολόγο ειδικά πανεπιστήμια. - Μ.: Υψηλότερη. school., 1989. - 432 p.
4,. Παρακολουθούμε το περιβάλλον της πόλης μας: βαθμοί 9-11: Σχολικό εργαστήριο. - Μ.: Ανθρωπότητα. ed. Κέντρο ΒΛΑΔΟΣ, 2001. - 112 σ.
5. Χημεία: Αναφ. ed. / V. Schroeter, Κ.-Η. Lautenschleger, Η. Bibrak et al .: Per. με αυτό. M .: Chemistry, 1989. - Per. ed., GDR, 1986.- 648 ρ.
Αλυσίδες μετασχηματισμού
1. Ανθρακικό ασβέστιο Οξείδιο ασβεστίου Υδροξείδιο ασβεστίου Ανθρακικό ασβέστιο Νιτρικό ασβέστιο.
2. Θειικό μαγνήσιο νιτρικό μαγνήσιο οξείδιο μαγνησίου.
3. Χλωριούχο ασβέστιο Θειικό ασβέστιο Θειικό ασβέστιο Θειικό ασβέστιο Υδροξείδιο ασβεστίου Οξείδιο ασβεστίου Υδρογονάνθρακας ασβεστίου.
4. Μαγνήσιο Οξείδιο του μαγνησίου Υδροξείδιο του μαγνησίου Χλωριούχο μαγνήσιο Υδρογονανθρακικό μαγνήσιο Υγρό μαγνήσιο Υδροξείδιο του μαγνησίου.
5. Θειούχο μαγνήσιο οξείδιο μαγνησίου ... υδροξείδιο μαγνησίου ... νιτρικό μαγνήσιο.
6. Ασβέστιο Υδροξείδιο του ασβεστίου Ανθρακικό ασβέστιο Οξείδιο του ασβεστίου Θειικό ασβέστιο Υδροξείδιο του ασβεστίου Υδρογονάνθρακας ασβεστίου.
Καθήκοντα Εκκαθάρισης
Επίπεδο Α
1. Η αλληλεπίδραση 13,7 g μετάλλου με νερό απελευθερώνει 2,24 λίτρα αερίου (n.a.). Προσδιορίστε το μέταλλο. Ποιο ίζημα και σε ποια ποσότητα σχηματίζεται εάν προστίθεται περίσσεια θειικού νατρίου στο προκύπτον διάλυμα;
Λύση
Το αέριο (Η2) απελευθερώνεται κατά τη διάρκεια της αλληλεπίδρασης των υποομάδων Mla και IIa με νερό.
Σύμφωνα με το νόμο των ισοδύναμων:
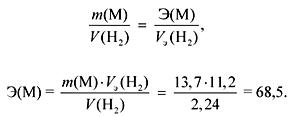
Εάν υπο-ομάδες M Ia, τότε
Α r (Μ) \u003d Ε δύναμη \u003d 68,5 (δεν υπάρχει τέτοιο μέταλλο).
Εάν υποομάδες M IIa, τότε
Α r (Μ) \u003d Ε valency \u003d 137 (Βα).
Ba + 2H20 \u003d Ba (ΟΗ) 2 + Η2,
Ba (ΟΗ) 2 + Na2S04 \u003d BaS04 + 2ΝaΟΗ,
(BaS04) \u003d (Βα (ΟΗ) 2) \u003d (Βα) \u003d\u003d 0,1 mol,
m(BaS04) \u003d Μ\u003d 0.1 233 \u003d 23.3 g.
Η απάντηση. Μέταλλο - Βα; m(BaS04) \u003d 23,3 g.
2. Ποιος όγκος διαλύματος υδροξειδίου του ασβεστίου 0,5 M πρέπει να προστεθεί σε 81 g διαλύματος 10% (πυκνότητα 1 g / cm 3) δισανθρακικού ασβεστίου για να ολοκληρωθεί ο σχηματισμός ιζημάτων; Προσδιορίστε τη μάζα των ιζημάτων.
Η απάντηση. 100 ml Ca (ΟΗ) 2, 10 g CaC03.
3. Το διάλυμα που περιέχει 23,3 g ενός μίγματος θειικού και χρωμικού καλίου επηρεάστηκε από περίσσεια χλωριούχου βαρίου. Το ίζημα απομακρύνθηκε με διήθηση, πλύθηκε και στη συνέχεια προστέθηκε σε αυτό περίσσεια υδροχλωρικού οξέος. Μέρος του ιζήματος διαλύθηκε, το υπόλοιπο τμήμα διηθήθηκε, πλύθηκε και ξηράνθηκε. Η μάζα του ιζήματος μετά την ξήρανση ήταν 23,3 g. Προσδιορίστηκε η σύνθεση του αρχικού μίγματος.
Η απάντηση. 17,4 g K2S04 και 5,9 g K2Cr04.
4. Υπάρχει ένα μείγμα ασβεστίου, οξειδίου του ασβεστίου και καρβιδίου ασβεστίου με μοριακή αναλογία συστατικών 1: 3: 4 (κατά σειρά ταξινόμησης). Ποιος όγκος νερού μπορεί να εισέλθει σε χημική αλληλεπίδραση με 35 g ενός τέτοιου μείγματος;
Η απάντηση. 17,568 ml.
5. Η διαλυτότητα υδροξειδίου του στροντίου σε νερό στους 100 ° C είναι 28 g και στους 25 ° C - 1 g ανά 100 g νερού. 200 g ενός διαλύματος υδροξειδίου του στροντίου κορεσμένου στους 100 ° C ψύχθηκαν στους 25 ° C. Βρείτε τη μάζα του οκταϋδρίτη υδροξειδίου του στροντίου που καθιζάνει όταν ψύχεται το διάλυμα.
Η απάντηση. 93.08 g Sr (ΟΗ) 2 8Η2Ο.
Επίπεδο Β
1. Μία μάζα κρυσταλλικού ανθρακικού μαγνησίου πλύθηκε μέχρι να σταματήσει η έκλυση αερίου. Οι τελευταίες διήλθαν μέσω φιαλών έκπλυσης με πυκνό θειικό οξύ και ασβέστιο νερό. Η μάζα της πρώτης φιάλης αυξήθηκε κατά 1,8 g και στα δεύτερα μειώθηκαν τα 2 g του ιζήματος. Προσδιορίστε τη σύνθεση του αρχικού κρυσταλλικού ένυδρου και τη μάζα του.
Η απάντηση. Πενταένυδρο MgCO3 5H2O; 3,48 g
2. Η γραμμομοριακή αναλογία ανθρακικού, όξινου ανθρακικού και νιτρικού ασβεστίου σε μίγμα που ζυγίζει 100 g είναι 1: 2: 3 (με τη σειρά καταχώρισης). Ποιος όγκος στους 1200 ° C και κανονική πίεση θα λάβει τα αέρια προϊόντα αποσύνθεσης αυτού του μίγματος;
Λύση
Οι εξισώσεις των αντιδράσεων αποσύνθεσης των συστατικών του μείγματος:
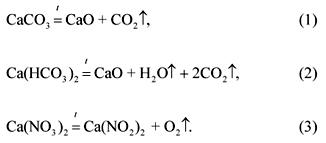
Με την κατάσταση του προβλήματος:
(CaC03): (Ca (HCO3) 2): (Ca (NO3) 2) \u003d 1: 2: 3.
Αφήνω (CaCO3) \u003d x το mole.
Στη συνέχεια (Ca (HCO3) 2) \u003d 2 x;
(Ca (NO3) 2) \u003d 3 x;
100x + 162 2x +164 3x \u003d100,
x 0,109 mol.
Στο σ \u003d 101,3 kPa και t \u003d 1200 ° C σε αέρια κατάσταση απελευθερώνεται:
CO 2 σύμφωνα με την εξίσωση (1):
1 (C02) \u003d (CaC03) \u003d x \u003d 0,109 mol.
Η2Ο, C02 σύμφωνα με την εξίσωση (2):
2 (Η2Ο) \u003d (Ca (HCO3) 2) \u003d 2 x \u003d 0,218 mol,
2 (C02) \u003d 2 (Ca (HCO3) 2) \u003d 4 x \u003d 0,436 mol.
O 2 σύμφωνα με την εξίσωση (3):
3 (02) \u003d (Ca (NO3) 2) \u003d 3 x \u003d 0,327 mol.
Ο συνολικός αριθμός γραμμομορίων προϊόντων αέριας αποσύνθεσης:
0,109 + 0,218 + 0,436 + 0,327 \u003d 1,09 mol (η.α.).
Από την εξίσωση της κατάστασης των ιδανικών αερίων βρίσκουμε τον όγκο:
pV = RT,
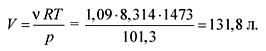
Η απάντηση. V \u003d 131,8 λίτρα
3. Ένα μίγμα ίσων ποσοτήτων δισθενούς υδροξειδίου και ανθρακικού μετάλλου υποβλήθηκε σε φρύξη. Η μάζα του στερεού υπολείμματος αποδείχθηκε 1,775 φορές μικρότερη από τη μάζα του αρχικού μίγματος. Σε αυτό το υπόλειμμα προστέθηκε 10 φορές μία μεγάλη μάζα διαλύματος θειικού οξέος 5%. Υπολογίζεται το κλάσμα μάζας των ουσιών στο προκύπτον διάλυμα.
Η απάντηση. 6% MgS04.
4. Όταν το νερό κατεργάζεται με ένα μίγμα υδριδίου και νιτριδίου ενός δισθενούς μετάλλου με ίσα κλάσματα μάζας, σχηματίζεται ένα αέριο μίγμα με πυκνότητα υδρογόνου 2.658. Ρυθμίστε το μέταλλο που περιλαμβάνεται στις ενώσεις (μην περιστρέφετε τους αριθμούς κατά τον υπολογισμό!).
Η απάντηση. Ασβέστιο
5. Ένα πλακίδιο μαγνησίου 16 g προστέθηκε σε διάλυμα 16% θειικού χαλκού (II) βάρους 350 g. Όταν αφαιρέθηκε η πλάκα, τα κλάσματα μάζας των αλάτων που περιέχονται στο διάλυμα αποδείχθηκαν τα ίδια. Πόσες φορές αυξήθηκε η μάζα της πλάκας;
Η απάντηση. 4,5 φορές.
Καθήκοντα ποιότητας
1. Ποιες από αυτές τις ουσίες θα αλληλεπιδράσουν με υδροξείδιο του μαγνησίου: υδροχλωρικό οξύ, νιτρικό οξύ, διοξείδιο του άνθρακα, χλωριούχο νάτριο, υδροξείδιο του βαρίου, θειικό οξύ, οξείδιο του χαλκού (II);
Η απάντηση. HCl, HNO3, H2S04.
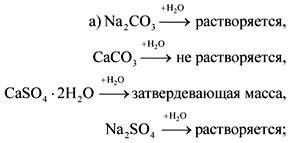
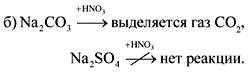
2. Σε φιάλες χωρίς ετικέτες είναι σόδα, κιμωλία, γύψος και θειικό νάτριο. Πώς μπορούν αυτές οι ουσίες να αναγνωριστούν με νερό και νιτρικό οξύ;
Η απάντηση.
3. Η ουσία Α είναι ένα ελαφρύ, αρκετά σκληρό ασήμι-λευκό μέταλλο. Στην αλληλεπίδραση της ουσίας Α με το Β, που είναι μια απλή αέρια ουσία, σχηματίζεται η ένωση C η οποία είναι διαλυτή στο νερό για να σχηματίσει ένα αλκαλικό διάλυμα. Κατά την επεξεργασία της ουσίας με θειικό οξύ, σχηματίζεται άλας, το κρυσταλλικό ένυδρο του οποίου χρησιμοποιείται στην ιατρική για την εφαρμογή σταθεροποιητικών επιδέσμων για κατάγματα. Δώστε τις εξισώσεις αντίδρασης.
Η απάντηση. Το Α είναι Ca. Το Β είναι Η2. Το C είναι CaH2. κρυσταλλικό ένυδρο - CaSO4 2Η2Ο.
4. Η ουσία Α είναι ένα οξείδιο διαλυτό στο νερό για να σχηματίσει ένα αλκαλικό διάλυμα. Η ένωση Β σε αυτό το διάλυμα αντιδρά με το άοσμο αέριο C για να σχηματίσει ένα λευκό ίζημα, το οποίο σταδιακά διαλύεται καθώς το αέριο C διέρχεται περαιτέρω. Δώστε τις εξισώσεις αντίδρασης και προσδιορίστε τις ουσίες.
Η απάντηση. Το Α είναι CaO, BaO. Το Β είναι Ca (OH) 2, Βα (ΟΗ) 2. Το C είναι C02.
5. Η ουσία Α, η οποία είναι μέρος ενός από τα πιο κοινά ορυκτά στη γήινη φλούδα, αποσυντίθεται σε υψηλή θερμοκρασία σε δύο οξείδια, ένα από τα οποία Β σχηματίζεται πάντα στη διαδικασία της ζωής. Όταν η ουσία Β αλληλεπιδρά με γραφίτη, όταν θερμαίνεται, το αέριο C, το οποίο είναι τοξικό για τα θερμόαιμα ζώα, είναι εύφλεκτο, άχρωμο και άοσμο. Δώστε τις εξισώσεις των αντιδράσεων, προσδιορίστε τις ουσίες.
Η απάντηση. Α - CaC03. Το Β είναι C02. C - CO.
Η σκληρότητα του νερού και η εξάλειψή του
Χημεία Περίληψη
Θέμα:"Σκληρότητα νερού"
Ανάδοχος έργου:Grabin Pavel.
Σχέδιο
Εισαγωγή 3
Προσδιορισμός της σκληρότητας του νερού. 3
Τεχνικές σκληρύνσεως 4
Αναφορές 6
Εισαγωγή
Στα σπήλαια, οι σπηλαιολόγοι συναντώνται με τους πιο όμορφους σχηματισμούς ασβεστόλιθου - οι σταλακτίτες κρέμονται από τις καμάρες και οι σταλαγμίτες που αναπτύσσονται προς τα πάνω. Από τη σκοπιά της χημείας, η εμφάνιση αυτών των εκπληκτικών δημιουργιών της φύσης είναι η ακαμψία των υπόγειων υδάτων. Αντιμετωπίζουμε την έννοια της σκληρότητας του νερού όχι μόνο στη σπηλαιολογία και τη γεωλογία, αλλά γενικά παντού - στη χημεία, στην τεχνολογία και ακόμα και στην καθημερινή ζωή. Επομένως, αυτή η έννοια είναι πολύ σημαντική για τον προσδιορισμό της ποιότητας του νερού.
Προσδιορισμός της σκληρότητας του νερού
Σκληρότητα νερού - η ιδιότητα του νερού (που δεν πρέπει να πλυθεί για να δώσει κλίμακα στους ατμολέβητες) που σχετίζεται με την περιεκτικότητα σε ασβέστιο και ενώσεις μαγνησίου διαλυτές σε αυτό, είναι μια παράμετρος που δείχνει την περιεκτικότητα των κατιόντων ασβεστίου και μαγνησίου στο νερό.
Σκληρότητα είναι οι ειδικές ιδιότητες του νερού, οι οποίες καθορίζουν σε μεγάλο βαθμό τις ιδιότητες του καταναλωτή του και επομένως έχουν σημαντική οικονομική αξία. Το σκληρό νερό σχηματίζει κλίμακα στους τοίχους των λεβήτων θέρμανσης, των μπαταριών κ.λπ., που υποβαθμίζουν σημαντικά τη θερμική τους απόδοση. Ένα τέτοιο λεπτό στρώμα στην επιφάνεια θέρμανσης δεν είναι καθόλου αβλαβές, καθώς η διάρκεια της θέρμανσης μέσω μιας στρώσης κλίμακας που έχει χαμηλή θερμική αγωγιμότητα αυξάνεται σταδιακά, ο πυθμένας καίει ταχύτερα και ταχύτερα - τελικά, το μέταλλο ψύχεται πιο αργά και αργά κάθε φορά, παραμένει σε θερμασμένη κατάσταση για μεγάλο χρονικό διάστημα. Στο τέλος, μπορεί να συμβεί ότι ο πυθμένας του σκάφους δεν θα αντέξει και θα επιτρέψει τη διαρροή. Αυτό το γεγονός είναι πολύ επικίνδυνο στη βιομηχανία όπου υπάρχουν ατμολέβητες.
Το σκληρό νερό δεν είναι κατάλληλο για πλύσιμο. Κλίμακα στους θερμαντήρες των πλυντηρίων ρούχων τους βγάζει εκτός της τάξης, επιδεινώνει επίσης τις ιδιότητες πλύσης του σαπουνιού. Τα κατιόντα Ca2 + και Mg2 + αντιδρούν με λιπαρά οξέα σαπουνιού για να σχηματίσουν ελάχιστα διαλυτά άλατα, τα οποία δημιουργούν φιλμ και ιζήματα, μειώνοντας τελικά την ποιότητα πλυσίματος και αυξάνοντας την κατανάλωση απορρυπαντικού, δηλ. Το σκληρό νερό αφρίζει ελάχιστα
Υπάρχουν δύο τύποι δυσκαμψίας: προσωρινός και μόνιμος. Η διαφορά αυτή οφείλεται στον τύπο των ανιόντων που υπάρχουν στο διάλυμα ως αντιστάθμισμα του ασβεστίου και του μαγνησίου.
Προσωρινή σκληρότητα που σχετίζονται με την παρουσία στο νερό μαζί με κατιόντα Ca2 +, Mg2 + και Fe2 + υδρογονανθρακικών ή δισανθρακικών ανιόντων (HCO 3 -).
Μόνιμη ακαμψία (ή μη ανθρακικό) ανακύπτει εάν στο διάλυμα υπάρχουν θειικά, χλωριούχα, νιτρικά και άλλα ανιόντα, τα άλατα ασβεστίου και μαγνησίου του είναι καλά διαλυτά και έτσι απλά δεν μπορούν να απομακρυνθούν. Η συνολική σκληρότητα ορίζεται ως η συνολική περιεκτικότητα όλων των αλάτων ασβεστίου και μαγνησίου στο διάλυμα.
Οι διαφορετικές χώρες έχουν τα δικά τους πρότυπα σκληρότητας για το νερό. Στη χώρα μας, το νερό ταξινομείται κατά σκληρότητα με αυτόν τον τρόπο:
Μαλακό νερό με σκληρότητα μικρότερη από 3,0 mEq / l,
Μεσαία σκληρότητα 3,0-6,0 mEq / L
Σκληρό - περισσότερο από 6,0 mEq / ml.
Μέθοδοι για την εξάλειψη της ακαμψίας.
Για να απαλλαγείτε από την προσωρινή σκληρότητα αρκεί να βράσετε νερό. Όταν ζεσταίνεται το νερό, τα διττανθρακικά ανιόντα αντιδρούν με κατιόντα και σχηματίζουν πολύ μικρά διαλυτά ανθρακικά άλατα με αυτά, τα οποία καθιζάνουν.
Ca2 + 2HCO3 - \u003d CaC03 ↓ + Η2Ο + C02
Με ιόντα σιδήρου, η αντίδραση είναι πιο περίπλοκη λόγω του γεγονότος ότι το FeCO3 είναι μια ασταθής ουσία στο νερό. Παρουσία οξυγόνου, το τελικό προϊόν της αλυσίδας αντίδρασης είναι Fe (ΟΗ) 3, το οποίο είναι ένα σκούρο κόκκινο ίζημα. Ως εκ τούτου, όσο περισσότερο σίδερο στο νερό, τόσο ισχυρότερο είναι το χρώμα στην κλίμακα, το οποίο εναποτίθεται στους τοίχους και τον πυθμένα του δοχείου κατά τη διάρκεια του βρασμού.
Η σταθερή δυσκαμψία είναι πιο δύσκολη. Μια επιλογή: πάγωμα πάγου. Απλά πρέπει να παγώσετε σταδιακά το νερό. Όταν παραμένει περίπου 10% του υγρού από την αρχική ποσότητα, είναι απαραίτητο να στραγγίσετε το μη παγωμένο νερό και γυρίστε τον πάγο πίσω στο νερό. Όλα τα άλατα, τα οποία σχηματίζουν σκληρότητα, παραμένουν στο μη παγωμένο νερό.
Το φαγητό είναι ένας τρόπος - η απόσταξη, δηλαδή η εξάτμιση του νερού με την επακόλουθη συμπύκνωσή του. Επειδή τα άλατα είναι μη πτητικές ενώσεις, παραμένουν και το νερό εξατμίζεται.
Ωστόσο, μέθοδοι όπως η κατάψυξη και η απόσταξη είναι κατάλληλες μόνο για την μαλάκυνση μιας μικρής ποσότητας νερού. Η βιομηχανία ασχολείται με τόνους. Ως εκ τούτου, χρησιμοποιούνται άλλες μέθοδοι. Η πιο ευρέως χρησιμοποιούμενη μέθοδος ανταλλαγής κατιόντων, με βάση τη χρήση ειδικών αντιδραστηρίων - κατιονανταλλακτών, τα οποία φορτώνονται στα φίλτρα και όταν διέρχεται νερό μέσω αυτών, αντικαθιστούν κατιόντα ασβεστίου και μαγνησίου με κατιόντα νατρίου.
Με συνέπεια της σκληρότητας της κλίμακας του νερού, από τη σκοπιά της χημείας, μπορείτε να πολεμήσετε πολύ εύκολα. Είναι απαραίτητο να επηρεάσει το αλάτι ενός ασθενούς οξέος με ένα ισχυρότερο οξύ. Ο τελευταίος αντικαθιστά τον άνθρακα, ο οποίος, ασταθής, αποσυντίθεται σε νερό και διοξείδιο του άνθρακα. Η σύνθεση της κλίμακας μπορεί να περιλαμβάνει πυριτικά άλατα και θειικά και φωσφορικά άλατα. Αλλά αν καταστρέψετε το ανθρακικό "σκελετό", τότε αυτές οι ενώσεις δεν θα παραμείνουν στην επιφάνεια.
Το αδιπικό οξύ και ο μηλεϊνικός ανυδρίτης, που προστίθενται στο νερό, χρησιμοποιούνται επίσης ως παράγοντες αραίωση. Αυτές οι ουσίες είναι ασθενέστερες από το σουλφαμικό οξύ, οπότε και ο βρασμός είναι απαραίτητος για την αφαλάτωση.
Παραπομπές:
Shpausus Z. Ταξίδι στον κόσμο της χημείας - Μόσχα: Εκπαίδευση, 1967. - 431s.
Kharlampovich G.D. και άλλα. Πολύπλευρη χημεία. - Μ.: Εκπαίδευση, 1992.-159 σελ.
Ο Khomchenko G.P. Εγχειρίδιο Χημείας-Μ .: New Wave, 1996. - 304ρ.
Παρόμοια δοκίμια:
Η μελέτη των ιδιοτήτων των αραιών διαλυμάτων των πολυαρυλατών, λαμβάνοντας υπόψη δύο παράγοντες: τη διαμόρφωση των μακρομορίων στο διάλυμα και την προσανατολιστική τάξη των μορίων των διαλυτών που τα διαλυτοποιούν, η οποία κρίθηκε από τις θερμοδυναμικές παραμέτρους και τη δομή του διαλύματος.
Σκοπός και δομή των φίλτρων παράλληλης ακρίβειας ιονίτη του πρώτου και δεύτερου σταδίου, μικτή δράση. Χαρακτηρισμός της τεχνολογίας αντίθετου ρεύματος ιονισμού. Περιγραφή της μεθόδου νατρίου-κατιονικού μαλακώματος νερού. Οι αρχές της αφαλάτωσης και της αφαλάτωσης του νερού.
Κατιοντοεναλλάκτες και τις ιδιότητές τους. Η διαδικασία μαλάκυνσης του νερού με κατιονισμό νατρίου. Αποσκληρυντής νερού με ανταλλαγή υδρογόνου-νατρίου-κατιόντος. Μέθοδοι υπολογισμού κατιόντων και μερικών κατιόντων. Φίλτρα ανταλλαγής κατιόντων και βοηθητικές διατάξεις εγκαταστάσεων ανταλλαγής κατιόντων.
Τι είναι ο αφρός και οι επιφανειοδραστικές ουσίες. Η επιφανειακή τάση ως το πιο σημαντικό χαρακτηριστικό της διεπαφής φάσης. Μέθοδοι πειραματικών μελετών για την επίδραση της σκληρότητας του νερού στην αφρίδα και την σταθερότητα του αφρού για διάφορους τύπους επιφανειοδραστικών ουσιών.
Ιδιότητες του νερού και μέθοδοι μαλάκυνσης. Απαιτήσεις για τη σκληρότητα του καταναλωθέντος νερού στη βιομηχανία θερμότητας και ηλεκτρικής ενέργειας. Θεωρητικά θεμέλια και μέθοδοι για τον προσδιορισμό της σκληρότητας του νερού με τη χρήση της σύνθετης μεθόδου. Δειγματοληψία, αντιδραστήρια, προσδιορισμός.
Η παραγωγή άνθρακα με θερμική αποσύνθεση του ξύλου, η απορρόφηση διαλυμένων ουσιών και αερίων από τον άνθρακα. Η αλληλεπίδραση του διοξειδίου του άνθρακα με τα αλκάλια, η παραγωγή μονοξειδίου του άνθρακα και η μελέτη των ιδιοτήτων του. Εξοικείωση με τις ιδιότητες ανθρακικών και δισανθρακικών.
Υποχρεωτικοί δείκτες της ποιότητας του πόσιμου νερού. Προσδιορισμός οργανικών ουσιών σε ιόντα νερού, χαλκού και μολύβδου. Μέθοδοι για την εξάλειψη της σκληρότητας του νερού. Τρόποι καθαρισμού του νερού. Παρασκευή ενός διαλύματος εργασίας θειικού καλίου. Καθαρισμός νερού με μερική κατάψυξη.
Χημικές ιδιότητες του ασβεστίου. Η χρήση καθαρού ανθρακικού ασβεστίου στην οπτική, ασβεστόλιθος στη μεταλλουργία - ως ροές. Γύψος ως κρυσταλλικό ένυδρο θειικό ασβέστιο. Άλας ασβεστίου φωσφορικού οξέος ως κύριο συστατικό φωσφοριτών και απατιτών.
Η ποικιλία των ενώσεων άνθρακα, η κατανομή τους στη φύση και η εφαρμογή τους. Αλλοτροπικές τροποποιήσεις. Φυσικές ιδιότητες και δομή του ελεύθερου ατόμου άνθρακα. Χημικές ιδιότητες του άνθρακα. Ανθρακικά και διττανθρακικά. Η δομή του διαμαντιού και του γραφίτη.
Χαρακτηρισμός της λιθόσφαιρας, σύνθεση χημικών στοιχείων και ορυκτών στο φλοιό της γης. Η δομή, η χημική σύνθεση και οι λειτουργίες της υδροσφαίρας, ατμόσφαιρα. Χαρακτηριστικά της φωτοσύνθεσης οργανικών ουσιών που απαντώνται στη βιόσφαιρα. Η μελέτη των βιογεωχημικών διεργασιών.
Η υψηλή σκληρότητα νερού στα συστήματα θέρμανσης και ζεστού νερού χρήσης επηρεάζει αρνητικά τις διαδικασίες μεταφοράς θερμότητας, αυξάνοντας την κατανάλωση ενέργειας. Επιπλέον, το σκληρό πόσιμο νερό είναι επιβλαβές για την ανθρώπινη υγεία. Για το νερό για διάφορους σκοπούς, χρησιμοποιούνται διάφορες μέθοδοι μαλάκυνσης.
Το μαλάκωμα του νερού είναι η διαδικασία απομάκρυνσης των αλάτων σκληρότητας από το νερό. Αλλά ποια είναι η σκληρότητα του νερού και γιατί πρέπει να αφαιρεθεί;
Η έννοια της σκληρότητας του νερού συνήθως συνδέεται με κατιόντα ασβεστίου (Ca2 +) και, σε μικρότερο βαθμό, με μαγνήσιο (Mg2 +). Στην πραγματικότητα, όλα τα δισθενή κατιόντα σε ένα ή τον άλλο βαθμό επηρεάζουν την ακαμψία. Συνδέονται με ανιόντα, σχηματίζοντας ενώσεις (άλατα σκληρότητας) που μπορούν να καταβυθιστούν.
Άλατα σιδήρου, μαγγανίου και στροντίου μπορούν επίσης να καταβυθιστούν, αλλά στην πράξη όλα αυτά τα στοιχεία έχουν τόσο μικρή επίδραση στη δυσκαμψία που συνήθως παραμελούνται.
Το αλουμίνιο (Al 3+) και ο σιδηρούχος σίδηρος (Fe 3+) επηρεάζουν επίσης τη σκληρότητα, αλλά στα επίπεδα pH που υπάρχουν στα φυσικά ύδατα, η διαλυτότητα τους και συνεπώς η "συμβολή" στη σκληρότητα είναι αμελητέα. Ομοίως, δεν λαμβάνεται υπόψη το ασήμαντο αποτέλεσμα του βαρίου (Ba2 +).
Τύποι δυσκαμψίας
Υπάρχουν διάφοροι τύποι σκληρότητας νερού. Η συνολική σκληρότητα προσδιορίζεται από τη συνολική συγκέντρωση ιόντων ασβεστίου και μαγνησίου. Είναι το άθροισμα της ακαθαρσίας ανθρακικών (προσωρινών) και μη ανθρακικών (μόνιμων).
Η σκληρότητα του ανθρακικού άλατος οφείλεται στην παρουσία υδρογονανθράκων και ανθρακικών αλάτων σε νερό (σε pH\u003e 8,3). Η προσωρινή σκληρότητα χαρακτηρίζεται από την παρουσία στο νερό μαζί με τα κατιόντα Ca 2+, Mg 2+ και Fe 2+ υδρογονανθρακικών ή διττανθρακικών ανιόντων (HCO 3). Αυτός ο τύπος σκληρότητας εξαλείφεται σχεδόν πλήρως με βραστό νερό και γι 'αυτό ονομάζεται προσωρινή σκληρότητα. Όταν θερμαίνεται νερό, τα υδρογονάνθρακες αποσυντίθενται για να σχηματίσουν ανθρακικό οξύ και καθιζάνουν ανθρακικό ασβέστιο, υδροξείδιο του μαγνησίου και σίδηρο.
Η μη ανθρακική σκληρότητα οφείλεται στην παρουσία αλάτων ασβεστίου και μαγνησίου ισχυρών οξέων (θειικό, νιτρικό, υδροχλωρικό) και δεν εξουδετερώνεται με βρασμό, επομένως έχει λάβει το όνομα σταθερής σκληρότητας.
Μονάδες
Στην παγκόσμια πρακτική, χρησιμοποιούνται διάφορες μονάδες δυσκαμψίας, όλες συσχετίζονται με κάποιο τρόπο μεταξύ τους.
Η μονάδα σκληρότητας λαμβάνεται ως η σκληρότητα του νερού, σε 1 λίτρο του οποίου περιέχει 1 mmol ισοδύναμων Ca2 + ή Mg2 +. Μία μονάδα σκληρότητας (1 mmol / L) αντιστοιχεί στην περιεκτικότητα σε ιόντα ασβεστίου ίση με 20.04 mg / L ή σε ιόντα μαγνησίου ίση με 12.15 mg / L Η συνολική σκληρότητα του νερού (H) μπορεί να υπολογιστεί με τον τύπο:
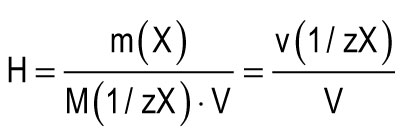
m (X) είναι η μάζα της διαλυμένης ουσίας, mg. M (1 / zX) είναι η γραμμομοριακή μάζα του ισοδύναμου της ουσίας, mg / mmol (g / mol). V είναι ο όγκος του νερού, l. Μ (1 / zCa2 +) \u003d 20,04 mg / mmol. Μ (1 / zMg2 +) \u003d 12,15 mg / mmol.
Επιπροσθέτως, στις χώρες του εξωτερικού χρησιμοποιούνται ευρέως μονάδες ακαμψίας όπως το γερμανικό πτυχίο (˚d, dH), το γαλλικό πτυχίο (˚f), ο αμερικανικός τίτλος και το ppm CaCO 3.
Ο λόγος αυτών των μονάδων ακαμψίας παρουσιάζεται στον πίνακα. 1.
Πίνακας 1. Αναλογία διαφορετικών μονάδων δυσκαμψίας
Έτσι, ένας γερμανικός βαθμός αντιστοιχεί σε 10 mg / dm3 CaO ή 17,86 mg / dm3 CaC03 σε νερό. Ένας γαλλικός βαθμός είναι 10 mg / dm3 CaC03 σε νερό και ο αμερικανικός βαθμός ισοδυναμεί με 1 mg / dm3 CaC03 σε νερό.
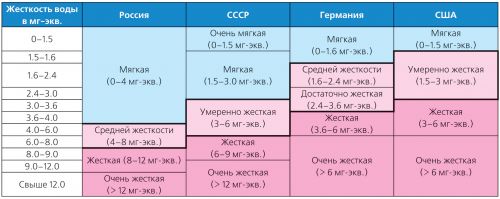
Η σκληρότητα του νερού ποικίλλει ευρέως και υπάρχουν πολλοί τύποι ταξινομήσεων. Έτσι στη Γερμανία εφαρμόζονται τα πρότυπα ακαμψίας του Γερμανικού Ινστιτούτου Τυποποίησης (DIN 19643), και στις ΗΠΑ - η ταξινόμηση που υιοθετήθηκε από την Υπηρεσία Προστασίας του Περιβάλλοντος (USEPA) το 1986 (Πίνακας 2).
Πίνακας 2. Ταξινόμηση διαφορετικών τύπων δυσκαμψίας
Ποιο νερό είναι πιο μαλακό
Χαρακτηριστικά, στα ύδατα με χαμηλά μεταλλεύματα, η σκληρότητα κυριαρχεί λόγω ιόντων ασβεστίου (αν και σε μερικές σπάνιες περιπτώσεις η σκληρότητα του μαγνησίου μπορεί να φτάσει το 50-60%). Με την αύξηση του βαθμού γενικής ανοργανοποίησης του νερού, η περιεκτικότητα σε ιόντα ασβεστίου (Ca2 +) μειώνεται ταχέως και σπάνια υπερβαίνει το 1 g / l. Η περιεκτικότητα σε ιόντα μαγνησίου (Mg2 +) σε εξαιρετικά μεταλλικά νερά μπορεί να φτάσει σε λίγα γραμμάρια, ενώ σε λίμνες αλάτι - δεκάδες γραμμάρια ανά λίτρο νερού.
Γενικά, η σκληρότητα επιφανειακών υδάτων είναι γενικά μικρότερη από τη σκληρότητα των υπόγειων υδάτων. Η σκληρότητα των επιφανειακών υδάτων υπόκειται σε αισθητές εποχιακές διακυμάνσεις, οι οποίες συνήθως φθάνουν τη μεγαλύτερη αξία τους στο τέλος του χειμώνα και οι χαμηλότερες κατά τη διάρκεια της πλημμύρας, όταν αραιώνονται άφθονα με μαλακή βροχή και με νερό τήξης. Το νερό της θάλασσας και των ωκεανών έχει πολύ μεγάλη σκληρότητα (δεκάδες και εκατοντάδες meq / l).
Συνέπειες της δυσκαμψίας
Το σκληρό πόσιμο νερό είναι πικρό λόγω της γεύσης του μαγνησίου και έχει αρνητική επίδραση στο πεπτικό σύστημα. Σύμφωνα με τα πρότυπα της Παγκόσμιας Οργάνωσης Υγείας (ΠΟΥ), η βέλτιστη σκληρότητα του πόσιμου νερού είναι 1,0-2,0 mEq / l.
Τα προϊόντα διατροφής υποβάλλονται σε έντονη πέψη σε σκληρό νερό, καθώς τα κατιόντα ασβεστίου με πρωτεΐνες τροφίμων σχηματίζουν αδιάλυτες ενώσεις. η θρεπτική τους αξία μειώνεται. Η συνεχής χρήση σκληρού νερού μπορεί να οδηγήσει στην απόθεση αλάτων (ουρολιθίαση) στο ανθρώπινο σώμα.
Το τσάι και ο καφές είναι κακώς παρασκευασμένα σε τέτοιο νερό. Σε οικιακές συνθήκες, μια περίσσεια αλάτων σκληρότητας οδηγεί στην απολέπιση των επιφανειών θέρμανσης στους λέβητες, τις τσαγιέρες, τους σωλήνες, την εναπόθεση αλάτων στα υδραυλικά συστήματα και την αποτυχία τους, αφήνοντας εναποθέσεις στα μαλλιά και στο δέρμα ενός ατόμου, δημιουργώντας μια δυσάρεστη αίσθηση της "σκληρότητας" τους.
Η σκληρότητα του νερού που χρησιμοποιείται για την παρασκευή διαφόρων προϊόντων ρυθμίζεται σαφώς και βρίσκεται στο επίπεδο 0,1-0,2 mEq / l.
Το σκληρό νερό σχηματίζει κλίμακα στους τοίχους των λεβήτων θέρμανσης, των μπαταριών κ.λπ., που μειώνει σημαντικά τη θερμική τους απόδοση, μειώνει το ελεύθερο τμήμα των αγωγών.
Οι αγωγοί είναι κατάφυτοι με αποθέσεις κλίμακας τόσο πολύ ώστε η παραγωγικότητά τους πέφτει αρκετές φορές. Επομένως, στις διαδικασίες εκείνες όπου η χρήση νερού με ορισμένη περιεκτικότητα σε άλατα είναι επιτρεπτή, η ακαμψία του περιορίζεται σε ακόμα χαμηλότερες τιμές - 0,03-0,05 mEq / l.
Κλίμακα στις συσκευές θέρμανσης των πλυντηρίων ρούχων τους θέτει εκτός λειτουργίας. Όταν πλένεται, αλληλεπιδρώντας με επιφανειοδραστικές ουσίες (επιφανειοδραστικές ουσίες) σαπουνιού ή απορρυπαντικών πλυντηρίων ρούχων, τα άλατα σκληρότητας τους δεσμεύουν και απαιτούν μεγαλύτερη κατανάλωση. Το σκληρό νερό δεν μπορεί να χρησιμοποιηθεί όταν πραγματοποιούνται ορισμένες τεχνολογικές διεργασίες, για παράδειγμα, κατά τη διάρκεια της βαφής, στην ηλεκτροχημεία κ.ο.κ.
Αφαίρεση αλατιού
Οι μέθοδοι εκχύλισης αλάτων Ca2 + και Mg2 + από το νερό σε επεξεργασία νερού ονομάζονται μαλακτικό νερό.
Η σχετικά επιλεκτική απομάκρυνση των αλάτων σκληρότητας από το νερό μπορεί να πραγματοποιηθεί με μεθόδους:
- θερμική επεξεργασία ·
- απόσταξη ·
- μαλακτικό αντιδραστηρίου.
- κατάψυξη ·
- μαγνητική επεξεργασία ·
- υπερηχητική επεξεργασία?
- ανταλλαγή ιόντων ·
- αντίστροφη όσμωση.
Οι μέθοδοι επεξεργασίας νερού είναι επίσης γνωστές (ηλεκτρομαγνητικά αποτελέσματα, προσθήκη πολυφωσφορικών ή άλλων "αντι-κλιμακωτών"), τα οποία επιτρέπουν την "δέσμευση" των αλάτων σκληρότητας για λίγο, εμποδίζοντας τους να πέσουν με τη μορφή κλίμακας για κάποιο χρονικό διάστημα. Ωστόσο, αυτές οι μέθοδοι δεν εξουδετερώνουν χημικά τα άλατα σκληρότητας, δεν τα απομακρύνουν πραγματικά και επομένως έχουν βρει περιορισμένη χρήση στην επεξεργασία βιομηχανικού νερού.
Θερμική μαλάκυνση
Με αυτό τον τρόπο, απαλλάσσονται από την προσωρινή ακαμψία που προκαλείται από δισανθρακικά ασβεστίου και μαγνησίου. Όταν βράζουν νερό, οι υδρογονάνθρακες αποσυντίθενται για να σχηματίσουν ένα ίζημα μέσου ή βασικού ανθρακικού άλατος:
Ca (HCO3) 2 \u003d CaC03 ↓ + C02 + Η2Ο,
Mg (HCO3) 2 \u003d Mg2 (OH) 2CO3 ↓ + 3CO2 + Η2Ο.
Ως αποτέλεσμα, η σκληρότητα του νερού μειώνεται. Αυτός είναι ο λόγος για τον οποίο η δισταθική ακαμψία ονομάζεται προσωρινή.
Με ιόντα σιδήρου, η αντίδραση είναι πιο περίπλοκη λόγω του γεγονότος ότι το FeCO3 είναι μια ασταθής ουσία στο νερό. Παρουσία οξυγόνου, το τελικό προϊόν της αλυσίδας αντίδρασης είναι Fe (ΟΗ) 3, το οποίο είναι ένα σκούρο κόκκινο ίζημα. Ως εκ τούτου, όσο περισσότερο σίδερο στο νερό, τόσο ισχυρότερο είναι το χρώμα στην κλίμακα, το οποίο εναποτίθεται στους τοίχους και τον πυθμένα του δοχείου κατά τη διάρκεια του βρασμού.
Έτσι, όταν βράζει νερό στην καθημερινή ζωή, συμβαίνει ταυτόχρονα η διαδικασία μερικής μαλάκυνσης.
Απόσταξη
Η απόσταξη είναι μια παραδοσιακή, αποτελεσματική και αξιόπιστη μέθοδος που παρέχει υψηλό βαθμό καθαρισμού πολύ αλμυρού νερού με υψηλή αλατότητα και σκληρότητα.
Η γενική αρχή της απόκτησης ύδατος με τη μέθοδο αυτή είναι η ακόλουθη: το προετοιμασμένο πόσιμο νερό εισέρχεται στον αποστακτήρα, ο οποίος αποτελείται από τρία βασικά συστατικά: έναν εξατμιστή, έναν συμπυκνωτή και έναν συλλέκτη.
Ο εξατμιστής με νερό θερμαίνεται σε βρασμό. Οι υδρατμοί εισέρχονται στον συμπυκνωτή, όπου υγροποιούνται και με τη μορφή αποστάγματος εισέρχονται στον συλλέκτη. Όλες οι μη πτητικές ακαθαρσίες που υπάρχουν στο νερό της πηγής παραμένουν στον αποστακτήρα.
Για να ληφθεί καθαρό νερό, χρησιμοποιούνται οι οινοπνευματοποιοί, οι οποίοι διαφέρουν μεταξύ τους στον τρόπο θέρμανσης, παραγωγικότητας και σχεδιασμού.
Η μέθοδος της απλής απόσταξης είναι ασύμφορη, αφού όταν χρησιμοποιείται, υπάρχει υψηλό κόστος ενέργειας για θέρμανση και εξάτμιση (περίπου 3000 kJ ανά 1 kg ατμού), καθώς και κατανάλωση νερού για συμπύκνωση ατμού (περίπου 8 λίτρα νερού 1 kg ατμού). Ως εκ τούτου, συνιστάται η χρήση μίας μόνο απόσταξης για χαμηλή κατανάλωση νερού - 10-20 l / h.
Οι αποδοτικότερες και οικονομικότερες από την συμβατική απόσταξη είναι οι πολυσταθμοποιητές υψηλής απόδοσης. Αλλά είναι εξαιρετικά ακριβά, επιπλέον, το κόστος της προεπεξεργασίας του νερού για αυτούς είναι υψηλό.
Αξίζει να σημειωθεί ότι η μέθοδος απόσταξης απομακρύνει όλα τα διαλυμένα άλατα στο νερό πηγής.
Εφαρμογή αντιδραστηρίου
Υπάρχει μαλάκυνση του νερού με ασβέστη, σόδα-limping και νατρίου-νατρίου μέθοδο μαλακώματος του νερού.
Όταν γίνεται ασβέστιο, στο διάλυμα προστίθεται ενυδατωμένος ασβέστος Ca (OH) 2 σε ρΗ περίπου 10. Ως αποτέλεσμα, οι αντιδράσεις συνεχίζονται:
Ca (HCO3) 2 + Ca (OH) 2 \u003d 2 CaC03 + 2Η2Ο,
Mg (HCO3) 2 + 2Ca (ΟΗ) 2 \u003d Mg (ΟΗ) 2 + 2CaCO3 + 2Η2Ο.
Αυτή η μέθοδος χρησιμοποιείται για υψηλή περιεκτικότητα σε ανθρακικά άλατα και χαμηλή μη ανθρακική σκληρότητα νερού, όταν απαιτείται ταυτόχρονη μείωση της σκληρότητας και της αλκαλικότητας. Η υπολειπόμενη ακαμψία είναι 0.4-0.8 mEq / L υψηλότερη από τη μη-ανθρακική ακαμψία.
Όταν προστίθεται ανθρακικό ασβέστιο, προστίθενται στο νερό ασβεστοποιημένο ασβέστιο Ca (OH) 2 και ανθρακικό νάτριο Na2CO3 σε ρΗ περίπου 10. Κατά συνέπεια, εμφανίζονται οι ακόλουθες αντιδράσεις:
Ca (HCO3) 2 + Ca (OH) 2 + Na2C03 \u003d 2 CaC03 + 2ΝaΟΗ + H2C03,
Mg (HCO3) 2 + 2NaOH \u003d Mg (ΟΗ) 2 + 2ΝaΗCΟ3.
Όπως προκύπτει από τις εξισώσεις αντίδρασης, στη διαδικασία σχηματισμού και ιζηματοποίησης των ιζημάτων από το νερό, τα άλατα σκληρότητας εξάγονται. Μαζί με αυτά, αφαιρούνται κολλοειδή και αιωρούμενα σωματίδια με σχετική ρύπανση. Το οργανικό ίζημα είναι μερικώς απορροφημένο στις νιφάδες των ιζημάτων.
Με την άσβεσμωση, λόγω της περίσσειας των ιόντων HCO3, επιτυγχάνεται μεγαλύτερη πληρότητα απομάκρυνσης των αλάτων σκληρότητας από το νερό. Η αύξηση της θερμοκρασίας στους 70-80 ° C σας επιτρέπει να φέρετε την υπολειπόμενη ακαμψία στα 0.35-1.0 mEq / L. Το ίδιο αποτέλεσμα μπορεί να επιτευχθεί με την αύξηση των δόσεων των αντιδραστηρίων.
Μέθοδος σόδα σόδας
Η προσθήκη σόδας είναι απαραίτητη εάν η μη ανθρακική σκληρότητα είναι μεγαλύτερη από την ανθρακική. Εάν αυτές οι παράμετροι είναι ίσες, η προσθήκη σόδας ίσως να μην είναι απαραίτητη.
Οι υδρογονάνθρακες ασβεστίου και μαγνησίου σε αντίδραση με αλκάλια σχηματίζουν ελάχιστα διαλυτές ενώσεις ασβεστίου και μαγνησίου, σόδας, νερού και διοξειδίου του άνθρακα:
Ca (HCO3) 2 + 2NaOH \u003d CaC03 ↓ + Na2CO3 + 2H2O,
Mg (HCO3) 2 + 2NaOH \u003d Mg (ΟΗ) 2 + + Na2C03 + Η2Ο + C02.
Το διοξείδιο του άνθρακα που σχηματίζεται ως αποτέλεσμα της αντίδρασης του όξινου ανθρακικού μαγνησίου με αλκαλικά αντιδρά ξανά με αλκάλια για να σχηματίσει σόδα και νερό:
CO2 + NaOH \u003d Na2C03 + Η2Ο.
Μη ανθρακική σκληρότητα
Το θειικό και το χλωριούχο ασβέστιο αντιδρούν με τη σόδα που σχηματίζεται στις αντιδράσεις της ανθρακικής σκληρότητας και των αλκαλίων και την προσθήκη σόδας για να σχηματίσουν ανθρακικό ασβέστιο που δεν κολλάει σε αλκαλικές συνθήκες:
CaCl2 + Na2CO3 \u003d CaC03 ↓ + 2NaCl,
CaS04 + Na2C03 \u003d CaC03 + + Na2S04.
Το θειικό μαγνήσιο και το χλωρίδιο αντιδρούν με αλκάλια για να σχηματιστεί κατακρημνισμένο υδροξείδιο του μαγνησίου:
MgS04 + 2ΝaΟΗ \u003d Mg (ΟΗ) 2 + + Na2S04,
MgCl2 + 2NaOH \u003d Mg (ΟΗ) 2 ↓ + 2NaCl.
Λόγω του γεγονότος ότι στις αντιδράσεις δισανθρακικού με αλκάλια σχηματίζεται σόδα, η οποία στη συνέχεια αντιδρά με σκληρότητα μη ανθρακικού, η ποσότητα της πρέπει να συσχετίζεται με την αναλογία σκληρότητας ανθρακικών (LFA) και μη ανθρακικών (LFA)
- αν είναι ίσες, η σόδα μπορεί να παραλειφθεί.
- υπό την προϋπόθεση Lc\u003e Lnc, σχηματίζεται μια περίσσεια σόδας.
- με την αναλογία της οθόνης LCD< Жнк - недостаток соды и ее необходимо добавлять.
Οι διεργασίες εναπόθεσης διεξάγονται σε δεξαμενές καθίζησης και καθαριστικά με στρώμα εναιωρούμενων ιζημάτων.
Οι δεξαμενές καθίζησης είναι ανεπαρκείς και ο πολτός υδροξειδίου που λαμβάνεται σε αυτά έχει υψηλή υγρασία 97-99%. Επομένως, επί του παρόντος δεν χρησιμοποιούνται ουσιαστικά.
Στην πράξη, χρησιμοποιούνται διάφορες εκδοχές των διαυγαστών με ένα στρώμα ιζηματοποιημένου ιζήματος. Σε αυτά, το προς καθαρισμό διάλυμα τροφοδοτείται από κάτω και διέρχεται από το στρώμα ιζήματος. Αυτό αυξάνει τον συντελεστή καθαρισμού του νερού.
Οι μέθοδοι αντιδραστηρίων δεν χρησιμοποιούνται στην παρασκευή πόσιμου νερού. Μετά από αυτά, το νερό έχει έντονα αλκαλική αντίδραση. Ως εκ τούτου, τα αντιδραστήρια χρησιμοποιούνται ευρέως στην ενέργεια και τη βιομηχανία ως το πρώτο στάδιο καθαρισμού σε μηχανικά φίλτρα. Όταν εργάζεστε μαζί, σας επιτρέπουν να μαλακώσετε το νερό, να αφαιρέσετε τα αιωρούμενα στερεά, συμπεριλαμβανομένων των κολλοειδών, και εν μέρει να καθαρίσετε το νερό από τις οργανικές ουσίες.
Κατάψυξη
Για την καταπολέμηση της σταθερής σκληρότητας του νερού, χρησιμοποιείται μια μέθοδος όπως η κατάψυξη του πάγου. Για να γίνει αυτό, απλά πρέπει να παγώσετε σταδιακά το νερό. Όταν περίπου το 10% του υγρού παραμένει από την αρχική ποσότητα, είναι απαραίτητο να στραγγίσετε το μη παγωμένο νερό και γυρίστε τον πάγο πίσω στο νερό. Όλα τα άλατα που σχηματίζουν σκληρότητα παραμένουν στο παγωμένο νερό.
Μαζί με την απόσταξη, είναι ταυτόχρονα ένας από τους τρόπους αφαλάτωσης του άλατος με υψηλή περιεκτικότητα σε αλάτι σε ποιότητα ποτού.
Άλλες μέθοδοι
Η μέθοδος ηλεκτροδιάλυσης βασίζεται στο φαινόμενο της κατευθυνόμενης κίνησης ιόντων ηλεκτρολυτών σε ηλεκτρόδια συνδεδεμένα σε δίκτυο συνεχούς ρεύματος. Έτσι, ιόντα μετάλλων, τα οποία καθορίζουν την σκληρότητα του νερού, παγιδεύονται στα ηλεκτρόδια και διαχωρίζονται από το νερό που εξέρχεται από τη συσκευή επεξεργασίας νερού.
Η μέθοδος μαγνητικού ιονισμού χρησιμοποιεί επίσης το φαινόμενο της κατευθυνόμενης κίνησης των ιόντων, αλλά ήδη υπό την επίδραση ενός μαγνητικού πεδίου. Για να αυξηθεί ο αριθμός των ιόντων στο νερό, προκαταρκτικά ακτινοβολείται με ιονίζουσα ακτινοβολία.
Η μαγνητική επεξεργασία του νερού συνίσταται στη διέλευση του νερού μέσω ενός συστήματος μαγνητικών πεδίων αντίθετων κατευθύνσεων. Ως αποτέλεσμα αυτού, υπάρχει μείωση του βαθμού ενυδάτωσης των διαλυμένων ουσιών και του συνδυασμού τους σε μεγαλύτερα σωματίδια που καθιζάνουν.
Η υπερηχητική επεξεργασία του νερού οδηγεί επίσης στον σχηματισμό μεγαλύτερων σωματιδίων διαλελυμένων ουσιών με το σχηματισμό ιζημάτων.
Συνιστάται να εξετάσετε λεπτομερώς τη μέθοδο ανταλλαγής ιόντων και αντίστροφης όσμωσης στο δεύτερο μέρος του άρθρου, το οποίο θα δημοσιεύσουμε στο περιοδικό μας στο επόμενο τεύχος.
