Ang tigas ng tubig at ang pag-aalis nito. Mga gawain at pagsasanay para sa mga metal ng iA subgroup
Pahina 1
Ang pag-alis ng pansamantalang katigasan ay isinasagawa sa pamamagitan ng tubig na kumukulo. Sa kumukulo, ang mga hydrocarbonates ay nawasak, at ang mahina na natutunaw na mga carbonates ay nabuo ng pag-uunlad. Kapag ang sodium carbonate, ang calcium hydroxide ay ipinakilala sa tubig, ang kabuuang tigas ng tubig ay tinanggal. Sa kasong ito, ang tigas na carbonate ay tinanggal ng dayap, at ang hindi tigas na karbonat ay tinanggal ng soda.
Bilang karagdagan sa pag-alis ng pansamantalang tigas, ang dayap ay umuurong sa lahat ng magnesiyo at bakal mula sa tubig at nagtataguyod ng coagulation ng mga organikong at organikong colloid.
Matapos malinis ang mga impurities, ang pag-alis ng pansamantalang tigas at pagpapatuyo, ang tubig na make-up ay pinapakain sa heat exchanger (2), kung saan pinainit ito sa 335 K. Matapos ang paghahalo, ang tubig na make-up at bumalik ay pumped sa ikalawang zone ng heat exchanger (2), kung saan pinainit sa 355 K at dumadaloy sa mga network ng pag-init.
Ang paglambot ay madalas na ginagamit upang maalis ang pansamantalang tigas ng tubig, na idinisenyo upang gumawa ng para sa mga pagkalugi (muling magkarga) sa saradong mga nagpapalibot na sistema ng supply ng tubig at upang maiwasan ang pag-atake ng mineral ng init at pagpapalitan ng tubig sa pakikipag-ugnay sa nagpapalipat-lipat na tubig. Sa maraming mga kaso, ang make-up na tubig ay ang pangunahing mapagkukunan ng akumulasyon ng mga ion ng calcium at biocarbonates sa nagpapalipat-lipat na tubig, na sa mga system na may mga coefficients ng pagsingaw ay maaaring makagambala sa matatag na komposisyon ng nagpapalipat-lipat na tubig.
Ang paglambot ng tubig upang maalis ang pansamantalang tigas ay isinasagawa sa kemikal sa pamamagitan ng pagpapakilala ng mga reagents, na ginagamit bilang dayap, asupre o hydrochloric acid. Nakakamit ang mga pamamaraan ng kemikal na medyo mababaw na paglambot ng tubig. Para sa isang mas mataas na antas ng paglambot, ang mga pamamaraan ng pagpapalitan ng cation ay ginagamit, ang kakanyahan kung saan ay ang paggamit ng kakayahan ng ilang mga sangkap upang makipagpalitan ng mga cation ng sodium na nilalaman sa kanila para sa mga cations ng tigas na tigas sa tubig.
Ang Caustic soda ay ginagamit sa mga thermal power halaman upang maalis ang pansamantalang tigas ng tubig, para sa pagbabagong-buhay ng mga anovitic filter na ginagamit sa mga halaman para sa desalination ng kemikal ng tubig.
Ang Caustic soda ay ginagamit sa mga thermal power halaman upang maalis ang pansamantalang katigasan ng tubig at upang mabagong muli ang mga anionic na filter na ginagamit sa mga halaman ng desalination kemikal.
Katulad nito, ang halaga ng Ca (OH) 2 na kinakailangan upang maalis ang pansamantalang higpit ay dapat ding kalkulahin.
Bakit, upang maalis ang pansamantalang higpit dahil sa mga asing-gamot na magnesiyo, kinakailangan ang maraming dayap kaysa alisin ang pansamantalang higpit dahil sa mga asing-gamot ng calcium.
Samakatuwid, upang muling magkarga ng closed (purge-free) na mga sistema ng supply ng tubig, medyo malalim na paglambot ng make-up na tubig at ang pag-aalis ng pansamantalang katigasan ay dapat gawin.
Ang pagpapakilala ng maliit na halaga ng mga alkalina na reagents ay nagdaragdag ng kahusayan ng magnetic na paggamot ng tubig, bagaman ang pagpapakilala ng mga alkalina reagents, halimbawa, dayap sa dami ng hindi hihigit sa 10 - 20% ng mga kinakailangan upang maalis ang pansamantalang katigasan, ayon sa mga pag-aaral na isinagawa sa KhIEI noong 1959, binabawasan ang pagbuo ng scale 8 hanggang 10 beses.
Sa kasong ito, ang anim na buto ng tubig na sanhi ng mga bicarbonates ay tinanggal. Samakatuwid, ang higpit na ito ay tinatawag na pansamantala, o bicarbonate. Samakatuwid, upang maalis ang pansamantalang higpit, sapat na upang pakuluan ang tubig.
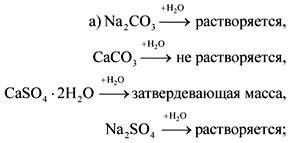
Ang mga asing-gamot na palagiang tigas, halimbawa, CaCl, CaSO4, atbp, ay hindi tinanggal mula sa tubig kapag pinainit. Pinahaba ang mga ito sa pagsingaw ng tubig, na bumubuo sa mga dingding ng aparatong mahirap tanggalin ang siksik na sukat. Maaaring gamitin lamang ang matigas na tubig sa mga kaso kung saan ang mga kondisyon ng paggamit nito ay hindi nagiging sanhi ng pag-ulan ng solidong pag-ulan, halimbawa, sa mga refrigerator na kung saan ang paglamig ng tubig ay hindi nag-init hanggang sa isang temperatura na makakatulong upang maalis ang pansamantalang katigasan. Sa mga halaman ng boiler, kung saan ang tubig ay hindi lamang pinainit, ngunit sumingaw din, hindi lamang pansamantala, kundi pati na rin ang palaging tigas na hindi katanggap-tanggap. Samakatuwid, ang tubig para sa kanila ay paunang nalinis mula sa kaltsyum at magnesiyo na asing-gamot sa pamamagitan ng isang pamamaraan ng kemikal sa mga espesyal na halaman.
Institusyong pang-edukasyon sa munisipalidad
"Pangalawang sekondaryong paaralan
may malalim na pag-aaral ng mga indibidwal na paksa
Address: Rehiyon ng Belgorod,
Pagsubok ng katigasan ng tubig
at mga paraan upang maalis ito
mag-aaral 11 "Isang" klase MOU "Average
pangalawang paaralan bilang 1
may malalim na pag-aaral
mga indibidwal na item
Address: Rehiyon ng Belgorod,
Tagapayo ng siyentipiko :,
guro ng kimika
pangalawang paaralan bilang 1
may malalim na pag-aaral
mga indibidwal na item
novy Oskol, Rehiyon ng Belgorod
Address: Rehiyon ng Belgorod,
novy Oskol,
novy Oskol
1. Panimula ………………………………………………………………… .3
2. Ang katigasan ng tubig at mga pamamaraan para sa pag-aalis nito …………………………… .4
· Bakit nagiging matigas ang tubig .............................................................. 4
· Ang halaga ng katigasan ng tubig sa buhay ng tao ...................................... 4
· Mga paraan upang maalis ang katigasan ………………………………… ... 5
3. Ang pag-aaral ng katigasan ng tubig at mga pamamaraan para sa pag-aalis nito .............. ... 8
4. Konklusyon at konklusyon
5. Listahan ng mga sanggunian
Panimula
Sino ang nag-aral ng mga agham, ngunit hindi ito inilapat,
katulad sa isa na dumarami, ngunit hindi naghahasik.
Saadi
Noong 80s ng ika-20 siglo, lumitaw ang mga libro ni Paul Chappius Bragg sa pagsulong ng isang malusog na pamumuhay. At bagaman maraming mga iskolar ang isinasaalang-alang ang kanyang opinyon kontrobersyal, ang mga libro ni Paul Bragg ay nararapat pansin. Ang isa sa mga seksyon ng kanyang libro (Ang aking unang mga eksperimento na may katigasan) ay nakatuon sa problema ng tigas na tubig, kung saan inilarawan ng may-akda sa kanyang mga alaala ang sakit ng kanyang lolo, na namatay mula sa katotohanan na ang kanyang mga daluyan ng dugo ay naging petrolyo mula sa matigas na tubig, at ang babaeng nanirahan sa kanilang mga bahagi ( ang kapus-palad na babae ay tinawag na isang babaeng bato, dahil ang kanyang katawan ay literal na petrolyo ng isang malaking bilang ng mga asing-gamot). Ang babaeng iyon ay isa sa maraming mga biktima ng matigas na tubig. Ang mga kapus-palad na organo ay nabigo upang makaya ang pagproseso ng isang malaking halaga ng mga di-organikong sangkap na nilalaman sa naturang tubig, at nagsimula silang mag-ipon ng napaka-aktibo sa kanyang katawan.
Ang mga compound ng calcium ay namumula sa ating mga katawan sa anyo ng mga bato sa bato at pantog.
Ngayon, ang paggamot sa tubig ay hindi isang kapritso at pagpapayaman, bagkus isang mahalagang pangangailangan. Ang katotohanan ay ang mga hindi kasiya-siyang hindi pangkaraniwang bagay tulad ng scum, third-party smacks, amoy, pati na rin ang pagkakaroon ng isang maulap na pag-ulan hindi lamang nagiging sanhi ng maraming abala, ngunit din nagiging sanhi ng maraming mga sakit. Ang mababang kalidad na tubig ay nagtataguyod ng pagpapalabas ng mga asing-gamot, nagpapabilis sa proseso ng pagtanda ng katawan, at nagiging sanhi ng maraming mga sakit na maging talamak. Bilang karagdagan, ang klorin ay naglalaman ng isang bilang ng mga sangkap na maaaring maging sanhi ng cancer. Ngunit ang tubig ang batayan ng lahat ng buhay at hindi isang nag-iisang buhay na organismo ay maaaring magawa nang walang tubig. Halimbawa, ang isang tao ay binubuo ng tubig sa 60-65%. Samakatuwid, ang malinis na tubig ay mahalaga para sa bawat tao. Sa kasamaang palad, ang natural na tubig sa ating oras ay ganap na hindi angkop para sa pagkonsumo nang walang paunang paggamot, na kung saan ay nakumpirma ng iba't ibang mga pagsusuri ng tubig. Alam ng lahat na ang mga istasyon ng pagsasala, na kung saan ay isinasagawa ang paglilinis ng tubig, matagal nang nangangailangan ng mga pangunahing pag-aayos, at ang mga sistema ng supply ng tubig na kung saan ang tubig ay naihatid sa aming mga tahanan ay nangangailangan ng kapalit.
Ang pakay ng aming gawain ay pag-aralan ang antas ng katigasan ng tubig sa aming bayan.
Ang katigasan ng tubig at mga pamamaraan para sa pag-aalis nito
Bakit tumitigas ang tubig
Ang kaltsyum at ang mga compound nito ay kinakailangan para sa katawan: pagkatapos ng lahat, ito ay mula sa calcium orthophosphate Ca3 (P04) 2 na binubuo ang mga buto at ngipin ng mga tao at hayop. Nabuo sila mula sa natutunaw na mga compound ng calcium, na nagdadala ng dugo sa buong katawan. Salamat sa mga cation calcium na si Ca2 +, ang dugo ay nag-iisa, bumubuo ng mga clots, clogging sugat at huminto sa pagdurugo.
Ang mga compound ng calcium ay hindi lamang kapaki-pakinabang, ngunit napakasasama rin - halimbawa, kapag binibigyan nila ang tigas sa ordinaryong tubig. Sa pang-araw-araw na buhay, ang salitang "higpit", sa unang sulyap, ay maaari lamang mailapat sa solids: ang isang bench bench o isang stool sa kusina ay maaaring maging solid. Gayunpaman, matigas din ang tubig.
Ang pangunahing mapagkukunan ng mga asing-gamot ng magnesiyo at kaltsyum na pumapasok sa tubig ay ang mga pagdeposito ng apog, dyipsum, at dolomite na napawi ng natural na tubig.
Sa mga tubig na may mababang asin, karamihan sa mga ion ng calcium. Sa pamamagitan ng isang pagtaas sa antas ng mineralization, ang nilalaman ng mga ion ng kaltsyum ay bumababa nang mabilis at bihirang lumampas sa 1 g / l. Ang nilalaman ng mga magnesium ions sa mineralized na tubig ay maaaring umabot ng maraming gramo, at sa tubig ng asin maraming sampu-sampung gramo.
Ang tigas ng tubig - isang kumbinasyon ng mga kemikal at pisikal na katangian ng tubig na nauugnay sa nilalaman ng mga natunaw na asing-gamot ng mga alkalina na metal na metal dito, pangunahin ang kaltsyum at magnesiyo. Ang tubig na may mataas na nilalaman ng naturang mga asing-gamot ay tinatawag na matigas na tubig, na may mababang nilalaman - malambot. Mayroong pansamantalang higpit (carbonate) na nabuo ng hydrocarbonates at permanenteng higpit (non-carbonate) na sanhi ng pagkakaroon ng iba pang mga asing-gamot. Ang pansamantalang higpit ay dahil sa pagkakaroon ng calcium at magnesium bicarbonates (Ca (HCO3) 2; Mg (HCO3) 2) sa tubig. Ang patuloy na tigas ng tubig ay dahil sa pagkakaroon ng tubig ng sulfates, Ca at Mg chlorides (CaSO4, CaCl2, MgSO4, MgCl2).
Ang halaga ng katigasan ng tubig sa buhay ng tao
Ang tigas ng tubig ay ang kabuuan ng mga ion ng calcium Ca2 + at magnesium Mg2 + na natunaw sa tubig.
Ang mga ion ng calcium at magnesium ay hindi nakakapinsala sa mga nabubuhay na organismo, ngunit ang kanilang presensya sa tubig sa maraming dami ay hindi kanais-nais, dahil ang gayong tubig ay hindi angkop para sa mga pangangailangan sa sambahayan.
Sa matapang na tubig, ang pagkonsumo ng sabon at pulbos ay nagdaragdag kapag ang paghuhugas ng mga damit, karne at gulay ay dahan-dahang hinuhukay, at ang pagkilos ng tiyan ay nabawasan. Ang hard water ay hindi angkop para sa mga sistema ng supply ng tubig at kagamitan sa pag-init ng tubig.
Sinusukat ang katigasan sa katumbas ng milligrams bawat litro (mEq / L). Ang mga pamantayan sa industriya para sa pinahihintulutang mga halaga ng higpit ay nakasalalay sa uri ng kagamitan na ginamit. Karaniwan, ang matigas na tubig na may tigas na 1 mEq / L o higit pa ay isinasaalang-alang.
Ang tigas ay ang pinaka-karaniwang problema sa kalidad ng tubig. Sa orihinal, ang salitang "matigas na tubig" ay inilapat sa tubig na mahirap hugasan.
Ang matigas na tubig, kapag hugasan, nalulunod ang balat, ang bula ay hindi maganda nabuo sa ito kapag gumagamit ng sabon. Ang paggamit ng matigas na tubig ay nagdudulot ng sediment (scale) na lumitaw sa mga dingding ng mga boiler, sa mga tubo, atbp Kasabay nito, ang paggamit ng masyadong malambot na tubig ay maaaring humantong sa kaagnasan ng mga tubo, dahil, sa kasong ito, walang acid-base buffering na ibinigay ng hydrocarbonate (pansamantalang) higpit. Ang pagkonsumo ng matigas o malambot na tubig ay karaniwang hindi mapanganib sa kalusugan, bagaman mayroong katibayan na ang mataas na katigasan ay nag-aambag sa pagbuo ng mga bato sa ihi, habang ang mababang katigasan ay bahagyang nagdaragdag ng panganib ng sakit sa cardiovascular.
Ang katigasan ng likas na tubig ay maaaring magkakaiba-iba at hindi matatag sa buong taon. Ang pagtaas ng katigasan dahil sa pagsingaw ng tubig, bumababa sa panahon ng tag-ulan, pati na rin sa panahon ng pagtunaw ng niyebe at yelo.
Mga paraan upang maalis ang higpit
Makikilala pangkalahatang higpit, na binubuo ng pansamantala at pare-pareho.
Pakuluan.
Pansamantalang ang tigas (disposable o carbonate) ay dahil sa pagkakaroon ng Ca (HCO3) 2 at Mg (HCO3) 2 bicarbonates sa tubig. Ang tigas na carbon ay madaling alisin kumukulo ng tubigkung saan ang Ca2 + at Mg2 + ay inalis upang mabuo ang mga hindi matutunaw na mga pag-ubos:
Ca (HCO3) 2 CaCO3 ↓ + CO2 + H2O
Ang mga ion ng Mg ay umunlad sa anyo ng pangunahing carbonate o sa anyo ng magnesium hydroxide (sa pH\u003e 10.3).
2Mg2 + + OH) 2CO3 ↓ + CO2 + H2O
(Ang mga ion ay nabuo dahil sa pakikipag-ugnay ng mga ions na may tubig: at ang balanse ay lumipat sa kanan kapag pinainit).
Upang mabawasan ang tigas ng carbonate paraan ng paglilimita kung saan ipinakilala ang ginagamot na tubig dayapCa (OH) 2. Ang mga reaksyon na nagaganap sa pagpapakilala ng dayap ay maaaring isulat sa form na molekular:
Ca (HCO3) 2 + Ca (OH) 2 → 2CaCO3 ↓ + H2O
Mg (НСО3) 2 + Са (ОН) 2 → Mg (ОН) 2 ↓ + 2Са + + Н2О
Ang patuloy na tigas (hindi maaasahan o di-carbonate) ay pinapanatili kapag kumukulo ang tubig, dahil ang patuloy na tigas ay dahil sa pagkakaroon ng mga sulpate, klorido at iba pang mga asing-gamot ng Ca at Mg sa tubig. Sa dami, ito ay katumbas ng konsentrasyon ng Ca2 + at Mg2 + na mga Ion binawasan ang katigasan ng oras. Karaniwang ginagamit upang mabawasan ang tigas ng carbonate. kinakalkula soda (Na2CO3):
MgSO4 + Na2CO3 → MgCO3 ↓ + Na2SO4
Habang nagdaragdag dayap at soda maaari mong mapupuksa ang tigas na carbonate at hindi carbonate ( paraan ng dayap-soda).
Ang lahat ng katigasan ay tinanggal kahit na pagpapakilala sosa pospeyt, sosa tetraborate at iba pa .. Dahil ang orthophosphates ay hindi gaanong natutunaw kaysa sa carbonates, ang paggamit nila sa paglambot ng tubig ay mas maginhawa:
3CaSO4 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 3Na2SO4
Ang modernong paraan ng paglambot ng tubig ay batay sa gamit resin ng pertukaran ng ion - mga palitan ng ion (palitan ng kasyon at mga palitan ng anion). Ang mga palitan ng kation ay mga synthetic ion-exchange resins - aluminosilicates, halimbawa:
Ang kanilang komposisyon ay maaaring kondisyon na maipahayag ng pangkalahatang pormula Na2R, kung saan ang Na + ay isang mataas na mobile cation at R - ay isang maliit na butil ng cation na nagdadala ng negatibong singil.
Kapag ang matigas na tubig ay dumadaloy sa isang layer ng cation exchange resin, ang mga cation ay ipinagpapalit ayon sa mga reaksyon:
Ca2 + + Na2R → 2Na + + CaR
Mg2 + + + Na2R → 2Na + + MgR
Kaya, ang Ca2 + at Mg2 + na mga ion ay pumasa mula sa solusyon sa cation exchange resin. Upang maibalik ang dagta ng cation exchange, hugasan ito ng isang puro na solusyon ng NaCl:
CaR + 2NaCl → CaCl2 + Na2R
Pagkatapos ng paghuhugas, ang cation exchange resin ay maaaring magamit muli upang maalis ang higpit mula sa tubig.
Ang reverse osmosis. Ang pamamaraan ay batay sa pagpasa ng tubig sa pamamagitan ng semipermeable lamad (karaniwang polyamide). Kasama ang mga tigas na tigas, ang iba pang mga asing-gamot ay tinanggal din. Ang kahusayan sa paglilinis ay maaaring umabot sa 99.9%. Ang pamamaraang ito ay natagpuan ang pinakadakilang aplikasyon sa mga sistema ng paggamot ng pag-inom ng tubig sa domestic. Bilang isang kawalan ng pamamaraang ito, ang pangangailangan para sa paunang paghahanda ng tubig na ibinibigay sa reverse osmosis membrane ay dapat pansinin.
Electrodialysis Ito ay batay sa pag-alis ng mga asing-gamot mula sa tubig sa pamamagitan ng pagkilos ng isang electric field. Ang pag-alis ng mga ion ng mga natunaw na sangkap ay nangyayari dahil sa mga espesyal na lamad. Tulad ng sa reverse osmosis technology, ang iba pang mga asing-gamot ay tinanggal, bilang karagdagan sa mga hardness ion.
Paraan ng thermal. Batay sa pagpainit ng tubig, tinatanggal lamang ang pansamantalang (carbonate) higpit. Nakakahanap ng aplikasyon sa pang-araw-araw na buhay. Sa industriya ginagamit ito, halimbawa, sa mga halaman ng thermal power.
Muling paglambot. Ang pamamaraan ay batay sa pagdaragdag ng soda o slaked dayap sa tubig. Sa kasong ito, ang mga kaltsyum at magnesiyo na asing-gamot ay pumasa sa mga hindi matutunaw na mga compound at, bilang isang resulta, tumitindi. Ang pamamaraan na ito ay nabigyang-katwiran sa medyo mataas na pagkonsumo ng tubig, dahil ito ay nauugnay sa solusyon ng isang bilang ng mga tiyak na problema: pagsasala ng putik, tumpak na dosis ng reagent.
Cationization. Ang pamamaraan ay batay sa paggamit ng pag-load ng pag-load ng butil ng ion-exchange (madalas na mga resin ng ion-exchange). Ang nasabing pakikipag-ugnay, sa pakikipag-ugnay sa tubig, ay sumisipsip ng mga cation ng mga tigas na tigas (kaltsyum at magnesiyo). Bilang kapalit, depende sa ionic form, na nagbibigay ng mga sodium o hydrogen ion. Ang mga pamamaraan na ito ay ayon sa pagkakabanggit ay Na-cation at H-cation. Bilang isang patakaran, ang katigasan ng tubig ay bumababa sa isang yugto ng pag-catealisasyon ng sodium sa 0.05-0.1 mEq / L, na may dalawang yugto - hanggang 0.01 mEq / L.
Pinakamahusay na reagent Upang maalis ang pangkalahatang katigasan ng tubig, ang sodium otophosphate ay Na3PO4: 3Ca (HCO3) 2 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 6NaHCO3 3MgSO4 + 2Na3PO4 → Mg3 (PO4) 2 ↓ + 3Na2SO4 Ang calcium at magnesium orthophosphates ay napakahusay. mas mahusay na paglambot ng tubig. Sa industriya, ang paggamit ng mga filter ng ion-exchange, calcium at magnesium ion ay pinalitan ng sodium at potassium ion upang makabuo ng malambot na tubig. Ang isang tiyak na paglambot ng tubig ay nangyayari sa mga filter ng sambahayan para sa inuming tubig. Nagbigay ng mas kaunting sukat ang sinala na tubig. Ang tubig ay maaaring ganap na linisin sa pamamagitan ng pag-distill (distillation).
Ngayon may mga mahusay mga filter ng tubig na naka-install sa apartment nang walang mga problema at nagsisilbing isang mahusay na tool para sa mataas na kalidad na paggamot ng tubig. Marahil marami sa ngayon ang bumili ng de-boteng purified water sa mga supermarket. Ang pagpili ng nasabing tubig ay tunay na malaki, ngunit posible bang maging 100% sigurado sa kalidad nito? Marahil hindi! Iyon ang dahilan kung bakit ang paglilinis ng tubig sa tulong ng mga espesyal na idinisenyo na mga filter para sa paglilinis ay ang pinakamainam na solusyon para sa isang modernong tao na nagmamalasakit sa kanyang kalusugan at kalusugan ng kanyang mga mahal sa buhay. Ang mga sistema ng paglilinis ng tubig ay napaka magkakaibang. Bilang isang patakaran, naiiba sila: pagganap, ilang mga parameter, ang antas ng paglilinis ng tubig, pati na rin ang disenyo. Ang mga filter ng tubig ay perpektong malinis na tubig at ginagawang angkop para sa pag-inom, bawasan ang nilalaman ng aluminyo, iron, mangganeso, murang luntian, lahat ng mga uri ng nitrates. Bilang karagdagan, ang mga filter para sa paglilinis ng tubig ay makakatulong upang maalis ang hindi kasiya-siya na amoy, panlasa, pati na rin mapupuksa ang mga mikrobyo at bakterya na nilalaman ng tubig. Ang tubig na nalinis sa pamamagitan ng mga naturang sistema ay nagiging mas mahigpit, gayunpaman, hindi nawawala ang mga kapaki-pakinabang na sangkap na kinakailangan para sa katawan ng tao. Ang mga filter ng tubig ay isang mahusay na pagkakataon upang makatanggap ng purong tubig sa walang limitasyong dami nang hindi umaalis sa iyong bahay. Ang isang maayos na napiling filter ay magiging isang mahusay na solusyon sa problema ng malinis na tubig, mapabuti ang kalusugan at pahabain ang iyong kahabaan ng buhay.
Pag-aaral ng katigasan ng tubig at mga pamamaraan para sa pag-aalis nito
Ang tigas ng tubig ay dahil sa pagkakaroon ng mga ca2 + at Mg2 +. Ang mas mataas na nilalaman ng mga ito sa natural na tubig (tubig na dumadaan sa mga calcareous na bato at mga lupa), mas malaki ang tigas nito.
Sa dami, ang katigasan ng tubig ay ipinahayag bilang kabuuan ng milliequivalents ng mga ca2 + at Mg2 + na nilalaman sa isang litro ng tubig (meq / l). Ang isang milliequivalent ng katigasan ay tumutugma sa isang nilalaman na 20.04 mg / L ng mga ca2 + ion o 12.16 mg / L ng mga Mg2 + na mga ions.
Samakatuwid, kapag nalulutas ang mga problema, maaari mong gamitin ang formula:
(mmol - equiv / l),
saan m - ang masa ng sangkap na gumagawa ng katigasan ng tubig o ginamit upang maalis ang katigasan ng tubig, mg;
Ma- katumbas na masa ng sangkap na ito, g / mol;
V- dami ng tubig, l
Sa pamamagitan ng katigasan, lahat ng likas na tubig ay nahahati sa malambot(kabuuang tigas na mas mababa sa 2 mmol / l) at matigasna may isang average na antas ng paninigas (2-10 mmol / l) at isang mataas na antas ng paninigas (higit sa 10 mmol / l).
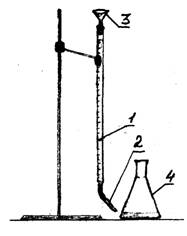
1 - burette
2 - dropper
3 - funnel
Larawan 1 - Pang-eksperimentong pag-setup
Karanasan sa pagganap
Sa tatlong mga flasks, sukatin na may isang malaking nagtapos na silindro 100 ml ng tubig. Magdagdag ng 2-3 patak ng tagapagpahiwatig ng methyl orange sa bawat flask na may tubig. Ang titration ay isinasagawa 0.1 N. hydrochloric acid solution gamit ang isang burette. Itakda ang antas ng acid sa burette sa zero division. Ibuhos ang hydrochloric acid dropwise hanggang sa magbago ang kulay ng solusyon mula sa dilaw hanggang orange-pink. Itala ang dami ng acid na napunta sa titration. Ulitin ang titration nang dalawang beses. Ipasok ang data sa talahanayan.
Ang pagkalkula ay ginagawa ayon sa pormula:
![]() (mmol - equiv / l),
(mmol - equiv / l),
kung saan ang normal na konsentrasyon ng hydrochloric acid;
Vcp ( Hcl) - average na dami HCl nawala para sa titration;
Vwater - ang dami ng tubig na kinuha para sa titration.
Ang nakuha na data na idinisenyo namin sa anyo ng isang talahanayan.
Sampol ng tubig
ginamit para sa titration
ginamit para sa titration ng na-filter na tubig
Tapikin ang tubig - kabinet ng kimika
Tubig mula sa gripo - st. Paglipad
Tubig mula sa gripo - st. Oktubre
Tubig mula sa haligi - p
Tubig mula sa gripo - st. Pokrovsky
Tubig mula sa balon Pokrovsky
Tubig mula sa gripo - st. Belgorod
Tubig mula sa gripo - st. Kawal
Soda tubig "Maganda"
Sa mga kondisyon ng laboratoryo ng paaralan, nagsagawa kami ng isang pag-aaral ng tubig na kinuha mula sa iba't ibang mga mapagkukunan para sa katigasan. Upang matukoy ang tigas, paggamit ng titration ng natural na tubig na may hydrochloric acid sa pagkakaroon ng isang tagapagpahiwatig ng methyl orange. Ang tigas na carbonate ng sample ng tubig ay natukoy bago at pagkatapos na maipasa ito sa isang filter ng sambahayan (ginamit ang Aquaphor).
Bilang resulta ng trabaho, ang mga sumusunod na konklusyon ay ginawa:
1) Ang tubig sa lungsod ng Novy Oskol ay mahirap (W \u003d 7-10.5). Maraming tao ang nakatira sa pribadong sektor at gumagamit ng tubig mula sa mga balon, at ang tubig na ito ay napakahirap.
2) Ang tubig na pumapasok sa suplay ng tubig ay sumasailalim sa paglilinis at paglambot (L \u003d 6-7), samakatuwid maaari itong isaalang-alang na katamtaman na katigasan (ayon sa GOST, ang kabuuang tigas ng inuming tubig ay hindi dapat higit sa 7 mmol / l).
3) Ang pinakamadaling paraan ng gawaing bahay upang mapahina ang tubig ay ayon sa kaugalian na kumukulo.
4) Ipinakita ng mga eksperimento na ang mga filter ng sambahayan ay perpektong nagpapahina din ng tubig. Kaya, ang tubig na kinuha para sa pananaliksik mula sa balon sa ul. Si Pokrovsky (tigas na 10.5 mmol / L), pagkatapos ng pag-filter, ay mayroong tigas na 2 mmol / L lamang, na mas mababa kaysa sa pisyolohikal na pamantayan (3.5 mmol / L). Kaya, ang mga filter ng tubig ay isang mahusay na pagkakataon upang makatanggap ng purong tubig sa walang limitasyong dami nang hindi umaalis sa iyong bahay.
Listahan ng mga sanggunian
1.,. isang gabay sa praktikal na pagsasanay sa kalinisan sa pamamaraan ng pananaliksik sa sanitary. - M .: "Paggamot", 19s.
2. at. Mga pundasyon ng pagsusuri ng kemikal. Gabay sa Pag-aaral para sa mga mag-aaral. - M .: "paliwanag", 1971. - 192 p.
3 .. Diorganikong kimika: Teksto. para sa technologist espesyal unibersidad. - M .: Mas mataas. paaralan., 1989 .-- 432 p.
4.,. Sinusubaybayan namin ang kapaligiran ng aming lungsod: mga grado 9-11: Pag-aaral sa paaralan. - M .: Sangkatauhan. ed. VLADOS Center, 2001. - 112 p.
5. Chemistry: Ref. ed./V. Schroeter, K.-H. Lautenschleger, H. Bibrak et al .: Per. kasama nito._ M .: Chemistry, 1989. - Per. ed .: GDR, 1986.- 648 p.
Mga Bantay sa Pagbabago
1. Kaltsyum Carbonate Kaltsyum Kaltsyum Kaltsyum Kaltsyum Hydroxide Calcium Carbonate Calcium Nitrate.
2. Magnesium sulfate magnesium nitrate magnesium oxide magnesium acetate.
3. Kaltsyum Chloride Calcium Sulphate Calcium Sulphide Calcium Sulphate Calcium Hydroxide Calcium Oxide Calcium Hydrocarbonate.
4. Magnesium Magnesium Oxide Magnesium Hydroxide Magnesium Chloride Magnesium Hydroxocarbonate Magnesium Sulfate Magnesium Hydroxide.
5. Magnesium sulfide magnesium oxide ... magnesium hydroxide ... magnesium nitrate.
6. Kaltsyum Kaltsyum Hydroksida Kaltsyum Carbonate Kaltsyum Kaltsyum Kaltsyum Kaltsyum Carbide Calcium Hydroxide Calcium Hydrocarbonate.
Mga Gawain sa Pag-areglo
Antas A
1. Ang pakikipag-ugnay ng 13.7 g ng metal na may tubig na naglalabas ng 2.24 litro ng gas (n.a.). Kilalanin ang metal. Anong pag-asa at sa kung anong dami ang nabuo kung ang isang labis na sodium sulfate ay idinagdag sa nagresultang solusyon?
Solusyon
Ang gas (H 2) ay inilabas sa panahon ng pakikipag-ugnayan ng mga sub-grupo ng M Ia at IIa na may tubig.
Ayon sa batas ng katumbas:
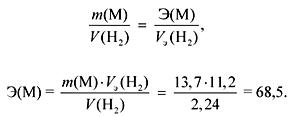
Kung ang mga sub-sub sa M Ia, kung gayon
A r (M) \u003d E valency \u003d 68.5 (walang ganoong metal).
Kung M IIa subgroups, kung gayon
A r (M) \u003d E valency \u003d 137 (Ba).
Ba + 2H 2 O \u003d Ba (OH) 2 + H 2,
Ba (OH) 2 + Na 2 KAYA 4 \u003d BaSO 4 + 2NaOH,
(BaSO 4) \u003d (Ba (OH) 2) \u003d (Ba) \u003d\u003d 0.1 mol,
m(BaSO 4) \u003d M\u003d 0.1 233 \u003d 23.3 g.
Ang sagot. Metal - Ba; m(BaSO 4) \u003d 23.3 g.
2. Anong dami ng 0.5 M calcium hydroxide solution ang dapat idagdag sa 81 g ng isang 10% na solusyon (density 1 g / cm 3) ng calcium bikarbonate upang makumpleto ang pagbuo ng sediment? Alamin ang masa ng sediment.
Ang sagot. 100 ml ng Ca (OH) 2, 10 g ng CaCO 3.
3. Ang solusyon na naglalaman ng 23.3 g ng isang halo ng potassium sulfate at chromate ay naapektuhan ng labis na barium klorido. Ang pag-ayos ay na-filter, hugasan, at pagkatapos ay isang labis na hydrochloric acid ay idinagdag dito. Ang bahagi ng pag-ayos ay natunaw, ang natitirang bahagi ay na-filter, hugasan at tuyo. Ang masa ng pag-ulan pagkatapos ng pagpapatayo ay 23.3 g. Alamin ang komposisyon ng paunang halo.
Ang sagot. 17.4 g ng K 2 KAYA 4 at 5.9 g ng K 2 CrO 4.
4. Mayroong halo ng calcium, calcium oxide at calcium carbide na may isang molar ratio ng mga sangkap ng 1: 3: 4 (sa pagkakasunud-sunod ng listahan). Anong dami ng tubig ang maaaring makapasok sa pakikipag-ugnayan ng kemikal na may 35 g ng naturang halo?
Ang sagot. 17.568 ml.
5. Ang solubility ng strontium hydroxide sa tubig sa 100 ° C ay 28 g, at sa 25 ° C - 1 g bawat 100 g ng tubig. Ang 200 g ng isang solusyon ng strontium hydroxide na saturated sa 100 ° C ay pinalamig sa 25 ° C. Hanapin ang masa ng strontium hydroxide octahydrate na pinahaba nang palamig ang solusyon.
Ang sagot. 93.08 g Sr (OH) 2 8H 2 O.
Antas B
1. Ang isang tiyak na masa ng mala-kristal na magnesium carbonate ay kinakalkula hanggang sa natapos ang ebolusyon ng gas. Ang huli ay pinasa sa pamamagitan ng flushing bote na may puro sulpuriko acid at dayap na tubig. Ang masa ng unang flask ay nadagdagan ng 1.8 g, at sa pangalawang 2 g ng pagkahulog ay nahulog. Alamin ang komposisyon ng nagsisimula na crystalline hydrate at ang masa nito.
Ang sagot. MgCO 3 5H 2 O pentahydrate; 3.48 g
2. Ang ratio ng molar ng carbonate, bikarbonate at calcium nitrate sa isang halo na may timbang na 100 g ay 1: 2: 3 (sa pagkakasunud-sunod ng listahan). Anong dami sa 1200 ° C at normal na presyon ang kukuha ng mga produktong gas na agnas ng halo na ito?
Solusyon
Ang mga equation ng mga reaksyon ng agnas ng mga sangkap ng pinaghalong:
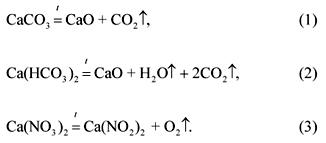
Sa pamamagitan ng kondisyon ng problema:
(CaCO 3): (Ca (HCO 3) 2): (Ca (HINDI 3) 2) \u003d 1: 2: 3.
Hayaan (CaCO 3) \u003d x ang nunal.
Pagkatapos (Ca (HCO 3) 2) \u003d 2 x;
(Ca (HINDI 3) 2) \u003d 3 x;
100x + 162 2x +164 3x \u003d100,
x 0.109 mol.
Sa p \u003d 101.3 kPa at t \u003d 1200 ° C sa isang estado ng gas na inilabas:
Ayon sa CO 2 ayon sa equation (1):
1 (CO 2) \u003d (CaCO 3) \u003d x \u003d 0.109 mol;
H 2 O, CO 2 ayon sa equation (2):
2 (H 2 O) \u003d (Ca (HCO 3) 2) \u003d 2 x \u003d 0.218 mol,
2 (CO 2) \u003d 2 (Ca (HCO 3) 2) \u003d 4 x \u003d 0.436 mol;
O 2 ayon sa equation (3):
3 (O 2) \u003d (Ca (HINDI 3) 2) \u003d 3 x \u003d 0.327 mol.
Ang kabuuang bilang ng mga moles ng mga produktong gas na agnas:
0.109 + 0.218 + 0.436 + 0.327 \u003d 1.09 mol (n.a.).
Mula sa equation ng estado ng mga ideal na gas nakita namin ang dami:
pV = RT,
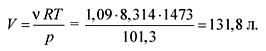
Ang sagot. V \u003d 131.8 litro
3. Ang isang halo ng pantay na halaga ng divalent metal hydroxide at carbonate ay na-calcined. Ang masa ng solidong nalalabi ay naging 1.775 beses mas mababa kaysa sa masa ng paunang pinaghalong. Sa nalalabi na ito ay idinagdag ng 10 beses sa isang malaking masa ng 5% sulfuric acid solution. Kalkulahin ang maliit na bahagi ng mga sangkap sa nagresultang solusyon.
Ang sagot. 6% MgSO 4.
4. Kapag ang tubig ay ginagamot ng isang pinaghalong isang haydride at nitride ng isang divalent metal na may pantay na mga praksyon ng masa, isang halo ng gas ay nabuo na may density ng hydrogen na 2.658. Itakda ang metal na kasama sa mga compound (huwag bilugan ang mga numero kapag kinakalkula!).
Ang sagot. Kaltsyum
5. Ang isang 16 g magnesium plate ay nahulog sa isang 16% na solusyon ng tanso (II) sulpate na tumitimbang ng 350 g. Kapag natanggal ang plato, ang mga mass fraction ng mga asing na nilalaman sa solusyon ay naging pareho. Ilang beses nadagdagan ang masa ng plate?
Ang sagot. 4.5 beses.
Mga Marka ng Gawain
1. Alin sa mga sangkap na ito ang makikipag-ugnay sa magnesium hydroxide: hydrochloric acid, nitric acid, carbon dioxide, sodium chloride, barium hydroxide, sulfuric acid, copper (II) oxide?
Ang sagot. HCl, HNO 3, H 2 KAYA 4.
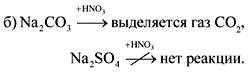
2. Sa mga bote na walang label ay soda, tisa, dyipsum at sodium sulfate. Paano makikilala ang mga sangkap na ito na may tubig at nitric acid?
Ang sagot.
3. Ang Kakayahan A ay isang ilaw, medyo matigas na pilak-puting metal. Sa pakikipag-ugnay ng sangkap A sa B, na kung saan ay isang simpleng gas na sangkap, ang compound C ay nabuo na natutunaw sa tubig upang makabuo ng isang solusyon sa alkalina. Kapag pinoproseso ang sangkap Gamit ang sulpuriko acid, ang asin ay nabuo, ang mala-kristal na hydrate na kung saan ay ginagamit sa gamot para sa aplikasyon ng mga fixative dressings para sa mga bali. Bigyan ang mga equation ng reaksyon.
Ang sagot. Ang A ay Ca; Ang B ay H 2; C ay CaH 2; mala-kristal na hydrate - CaSO 4 2H 2 O.
4. Ang Kakayahan A ay isang natutunaw na oxide sa tubig upang makabuo ng isang solusyon sa alkalina. Ang Compound B sa solusyon na ito ay tumugon sa walang amoy na gas C upang makabuo ng isang puting pag-ayos, na unti-unting natutunaw habang ang gas C ay pumasa.Bigyan ang mga equation ng reaksyon at kilalanin ang mga sangkap.
Ang sagot. Ang A ay CaO, BaO; Ang B ay Ca (OH) 2, Ba (OH) 2; Ang CO ay CO 2.
5. Ang Kakayahan A, na bahagi ng isa sa mga pinaka-karaniwang mineral sa crust ng lupa, nabubulok sa mataas na temperatura sa dalawang mga oxides, na kung saan ang isa sa B ay palaging nabuo sa proseso ng buhay. Kapag ang sangkap na B ay nakikipag-ugnay sa grapayt, kapag pinainit, gas C, na nakakalason sa mga hayop na may mainit na dugo, ay nasusunog, walang kulay at walang amoy. Bigyan ang mga equation ng mga reaksyon, kilalanin ang mga sangkap.
Ang sagot. A - CaCO 3; Ang B ay CO 2; C - CO.
Ang tigas ng tubig at ang pag-aalis nito
Abstract ng Chemistry
Tema:"Katigasan ng tubig"
Kontratista ng trabaho:Grabin Pavel.
Plano
Panimula 3
Pagpasya ng tigas ng tubig. 3
Mga Stiffening Techniques 4
Mga Sanggunian 6
Panimula
Sa mga kuweba, nakikipagkita ang mga cavers sa pinakamagagandang pormasyon ng apog - mga stalakmita na nakabitin mula sa mga arko at mga stalagmit na lumalaki paitaas. Mula sa punto ng pananaw ng kimika, ang paglitaw ng mga kamangha-manghang mga nilikha ng kalikasan ay ang mahigpit na tubig sa lupa. Natagpuan namin ang konsepto ng katigasan ng tubig hindi lamang sa speleology at geology, ngunit, sa pangkalahatan, saanman - sa kimika, teknolohiya at maging sa pang-araw-araw na buhay. At samakatuwid, ang konsepto na ito ay napakahalaga para sa pagtukoy ng kalidad ng tubig.
Pagpasya ng tigas ng tubig
Katigasan ng tubig - ang pag-aari ng tubig (hindi hugasan, upang bigyan ng sukat sa mga boiler ng singaw) na nauugnay sa nilalaman ng calcium at magnesium compound na natutunaw sa loob nito, ito ay isang parameter na nagpapakita ng nilalaman ng mga cation ng calcium at magnesium sa tubig.
Ang katigasan ay ang mga espesyal na katangian ng tubig, na higit sa lahat ay natutukoy ang mga katangian ng mga mamimili at samakatuwid ay may mahalagang halagang pang-ekonomiya. Ang mga hard water form scale sa mga dingding ng mga heat boiler, baterya, atbp, na makabuluhang nagpapabagal sa kanilang thermal performance. Ang nasabing isang manipis na layer sa ibabaw ng pag-init ay hindi lahat ay hindi nakakapinsala, dahil ang tagal ng pag-init sa pamamagitan ng layer ng scum, na may mababang thermal conductivity, unti-unting tumataas, ang ilalim ay mas mabilis na mas mabilis at mas mabilis - pagkatapos ng lahat, ang metal ay lumalamig nang mas mabagal at dahan-dahan sa bawat oras, nananatili ito sa isang pinainit na estado sa loob ng mahabang panahon. Sa huli, maaaring mangyari na ang ilalim ng daluyan ay hindi makatiis at payagan ang pagtagas. Ang katotohanang ito ay mapanganib sa industriya kung saan umiiral ang mga steam boiler.
Ang hard water ay hindi angkop para sa paghuhugas. Ang scale sa mga heaters ng washing machine ay naglalagay sa kanila ng pagkakasunud-sunod, pinapalala nito ang mga katangian ng paghuhugas ng sabon. Ang Ca 2+ at Mg 2+ cations ay gumanti sa mga sabong mataba acid upang mabuo ang hindi maayos na natutunaw na mga asing-gamot, na lumilikha ng mga pelikula at umuurong, sa huli ay binabawasan ang kalidad ng paghuhugas at pagtaas ng pagkonsumo ng naglilinis, i.e. mahirap tubig lathers mahina
Mayroong dalawang uri ng higpit: pansamantala at permanenteng. Ang pagkakaiba na ito ay dahil sa uri ng anion na naroroon sa solusyon bilang isang counterbalance sa calcium at magnesium.
Pansamantalang katigasan nauugnay sa pagkakaroon ng tubig kasama ang mga cations Ca 2+, Mg 2+ at Fe 2+ ng hydrocarbonate, o bicarbonate anion (HCO 3 -).
Permanenteng higpit (o di-carbonate) lumitaw kung ang sulpate, klorido, nitrate at iba pang mga anion ay naroroon sa solusyon, ang kaltsyum at magnesiyo asing-gamot na kung saan ay mahusay na natutunaw at sa gayon ay hindi maaaring alisin. Ang kabuuang katigasan ay tinukoy bilang kabuuang nilalaman ng lahat ng mga kaltsyum at magnesiyo na asin sa solusyon.
Ang iba't ibang mga bansa ay may sariling pamantayan sa katigasan para sa tubig. Sa ating bansa, ang tubig ay inuri ayon sa katigasan sa ganitong paraan:
Malambot na tubig na may tigas na mas mababa sa 3.0 mEq / l,
Katamtamang katigasan 3.0-6.0 mEq / L
Mahirap - higit sa 6.0 mEq / ml.
Mga pamamaraan upang maalis ang higpit.
Upang mapupuksa ang pansamantalang katigasan kailangan mo lamang pakuluan ng tubig. Kapag kumukulo ng tubig, ang mga bicarbonate anion ay gumanti sa mga kasyon at bumubuo ng napakahina na natutunaw na mga asing-gamot na carbonate sa kanila, na umuunlad.
Ca 2 + 2HCO 3 - \u003d CaCO 3 ↓ + H 2 O + CO 2
Sa mga iron iron, ang reaksyon ay mas kumplikado dahil sa ang katunayan na ang FeCO 3 ay isang hindi matatag na sangkap sa tubig. Sa pagkakaroon ng oxygen, ang dulo ng produkto ng reaksyon chain ay Fe (OH) 3, na isang madilim na pulang pag-ayos. Samakatuwid, ang mas bakal sa tubig, mas malakas ang kulay sa sukat, na idineposito sa mga dingding at ilalim ng daluyan habang kumukulo.
Ang patuloy na higpit ay mas mahirap labanan. Isang pagpipilian: nagyeyelong yelo. Kailangan mo lang unti-unting i-freeze ang tubig. Kung humigit-kumulang na 10% ng likido mula sa paunang halaga ay nananatili, kinakailangan na alisan ng tubig ang hindi naka-frozen na tubig, at ibalik sa tubig ang yelo. Ang lahat ng mga asing-gamot, na bumubuo ng isang tigas, ay nananatili sa hindi frozen na tubig.
Ang pagkain ay isang paraan - paglubog, iyon ay, ang pagsingaw ng tubig kasama ang kasunod na paghalay nito. Yamang ang mga asing-gamot ay hindi pabagu-bago ng mga compound, mananatili sila, at ang mga tubig ay sumingaw.
Ngunit ang mga pamamaraan tulad ng pagyeyelo at pag-distillation ay angkop lamang para sa paglambot ng kaunting tubig. Ang industriya ay nakikitungo sa tonelada. Samakatuwid, ginagamit ang iba pang mga pamamaraan. Ang pinakalawak na ginagamit na paraan ng pagpapalitan ng cation, batay sa paggamit ng mga espesyal na reagents - mga palitan ng cation, na na-load sa mga filter at kapag ang tubig ay dumaan sa kanila, palitan ang calcium at magnesium cation na may sosa cation.
Sa kinahinatnan ng katigasan ng scale ng tubig, mula sa punto ng pananaw ng kimika, maaari kang madaling labanan. Kinakailangan na maimpluwensyahan ang asin ng isang mahina na acid na may mas malakas na acid. Ang huli ay tumatagal ng lugar ng karbon, na, na hindi matatag, ay nabulok sa tubig at carbon dioxide. Ang komposisyon ng scale ay maaaring magsama ng silicates, at sulfates, at mga pospeyt. Ngunit kung sirain mo ang carbonate na "balangkas", kung gayon ang mga compound na ito ay hindi mananatili sa ibabaw.
Ang Adipic acid at maleic anhydride, na idinagdag sa tubig, ay ginagamit din bilang mga ahente ng bumulusok. Ang mga sangkap na ito ay mas mahina kaysa sa sulpiko acid, kaya ang kumukulo ay kinakailangan din para sa pagbaba.
Mga Sanggunian:
Shpausus Z. Paglalakbay sa mundo ng kimika - Moscow: Edukasyon, 1967. - 431s.
Kharlampovich G.D. at iba pa.Ang maraming panig na kimika. - M .: Edukasyon, 1992.-159 p.
Khomchenko G.P. Teksto ng Chemistry –M .: Bagong Wave, 1996. - 304p.
Katulad na sanaysay:
Ang pag-aaral ng mga pag-aari ng mga solusyon ng dilute ng mga polyary template na isinasaalang-alang ang dalawang mga kadahilanan: ang pagsasaayos ng macromolecules sa solusyon at ang pagkakasunud-sunod ng oryentasyon ng mga solong molekula na solvating, na hinuhusgahan ng mga thermodynamic parameter at istraktura ng solusyon.
Ang layunin at istraktura ng kahanay-tumpak na mga filter ng ionite ng una at pangalawang yugto, halo-halong pagkilos. Characterization ng countercurrent ionization technology. Paglalarawan ng sodium-cationic na paraan ng paglambot ng tubig. Ang mga prinsipyo ng desalination at desalination ng tubig.
Ang mga palitan ng kation at ang kanilang mga katangian. Ang proseso ng paglambot ng tubig sa pamamagitan ng sosa cationization. Hydrogen-sodium-cation exchange water softener. Mga pamamaraan ng calc-cationite at bahagyang cationization. Mga filter ng kation exchange at mga pandiwang pantulong na aparato ng pag-install ng cation exchange.
Ano ang bula at surfactant. Ang pag-igting sa ibabaw bilang pinakamahalagang katangian ng interface ng phase. Mga pamamaraan ng mga pang-eksperimentong pag-aaral ng impluwensya ng katigasan ng tubig sa foaming at foam katatagan para sa iba't ibang uri ng mga surfactant.
Mga katangian ng tubig at mga pamamaraan ng paglambot nito. Mga kinakailangan para sa tigas ng natupok na tubig sa industriya ng init at lakas. Ang mga teoretikal na pundasyon at mga pamamaraan para sa pagtukoy ng katigasan ng tubig gamit ang pamamaraang kumplikado. Sampling, reagents, pagpapasiya.
Ang paggawa ng carbon sa pamamagitan ng thermal agnas ng kahoy, ang pagsipsip ng mga natunaw na sangkap at gas sa pamamagitan ng karbon. Ang pakikipag-ugnay ng carbon dioxide sa alkali, ang paggawa ng carbon monoxide at ang pag-aaral ng mga katangian nito. Pamilyar sa mga katangian ng carbonates at bicarbonates.
Ang mga kondisyon na tagapagpahiwatig ng kalidad ng inuming tubig. Ang pagpapasiya ng mga organikong sangkap sa tubig, tanso at mga lead ion. Mga pamamaraan upang maalis ang katigasan ng tubig. Mga paraan upang linisin ang tubig. Paghahanda ng isang gumaganang solusyon ng potasa sulpate. Paglilinis ng tubig sa pamamagitan ng bahagyang pagyeyelo.
Mga kemikal na katangian ng calcium. Ang paggamit ng purong calcium carbonate sa optika, apog sa metalurhiya - bilang mga flux. Gypsum bilang isang calcium sulfate crystalline hydrate. Kaltsyum asin ng posporiko acid bilang pangunahing sangkap ng mga phosphorites at apatites.
Ang iba't ibang mga compound ng carbon, ang kanilang pamamahagi sa kalikasan at aplikasyon. Mga pagbabago sa Allotropic. Mga pisikal na katangian at istraktura ng libreng carbon atom. Mga katangian ng kemikal ng carbon. Carbonates at bicarbonates. Ang istraktura ng brilyante at grapayt.
Ang pagkilala sa lithosera, ang komposisyon ng mga elemento ng kemikal at mineral sa crust ng lupa. Ang istraktura, komposisyon ng kemikal at pag-andar ng hydrosmos, kapaligiran. Mga tampok ng fotosintesis ng mga organikong sangkap na nagaganap sa biosoffer. Ang pag-aaral ng mga proseso ng biogeochemical.
Ang mataas na katigasan ng tubig sa pagpainit at mga domestic hot water system ay negatibong nakakaapekto sa mga proseso ng paglipat ng init, pagtaas ng pagkonsumo ng enerhiya. Bilang karagdagan, ang matapang na inuming tubig ay nakakapinsala sa kalusugan ng tao. Para sa tubig para sa iba't ibang mga layunin, ginagamit ang iba't ibang mga pamamaraan ng paglambot.
Ang paglambot ng tubig ay ang proseso ng pag-alis ng mga tigas na tigas mula sa tubig. Ngunit ano ang katigasan ng tubig at bakit dapat itong alisin?
Ang konsepto ng katigasan ng tubig ay karaniwang nauugnay sa mga cation ng calcium (Ca 2+) at, sa isang mas mababang sukat, magnesiyo (Mg 2+). Sa katunayan, ang lahat ng mga divalent cations sa isang degree o iba pa ay nakakaapekto sa higpit. Nakikipag-ugnay sila sa mga anion, na bumubuo ng mga compound (mga tigas na tigas) na maaaring tumubo.
Ang mga asing-gamot na bakal, mangganeso, at strontium ay maaari ring umunlad, ngunit sa pagsasagawa ng lahat ng mga elementong ito ay may maliit na epekto sa higpit na karaniwang napapabayaan.
Ang aluminyo (Al 3+) at ferric iron (Fe 3+) ay nakakaapekto rin sa katigasan, ngunit sa mga antas ng pH na matatagpuan sa natural na tubig, ang kanilang pag-solubility at, nang naaayon, ang "kontribusyon" sa katigasan ay bale-wala. Katulad nito, ang hindi gaanong mahalagang epekto ng barium (Ba 2+) ay hindi isinasaalang-alang.
Mga Uri ng Kamatayan
Mayroong maraming mga uri ng tigas ng tubig. Ang kabuuang katigasan ay natutukoy ng kabuuang konsentrasyon ng mga ion ng calcium at magnesium. Ito ang kabuuan ng carbonate (pansamantalang) at hindi-carbonate (permanent) na higpit.
Ang tigas ng karbonat ay dahil sa pagkakaroon ng hydrocarbonates at carbonates sa tubig (sa pH\u003e 8.3). Ang pansamantalang tigas ay nailalarawan sa pamamagitan ng pagkakaroon sa tubig kasama ang mga cations Ca 2+, Mg 2+ at Fe 2+ ng hydrocarbonate, o bicarbonate anions (HCO 3-). Ang ganitong uri ng tigas ay halos ganap na tinanggal ng tubig na kumukulo at na ang dahilan kung bakit tinawag itong pansamantalang katigasan. Kapag ang tubig ay pinainit, ang mga hydrocarbonates ay nabulok upang mabuo ang carbonic acid at umasim ng calcium carbonate, magnesium hydroxide at iron.
Ang hindi tigas na karbonat ay dahil sa pagkakaroon ng calcium at magnesium salts ng mga malakas na acid (sulfuric, nitric, hydrochloric) at hindi tinanggal sa pamamagitan ng kumukulo, samakatuwid natanggap na nito ang pangalan ng patuloy na tigas.
Mga Yunit
Sa pagsasanay sa mundo, maraming mga yunit ng paninigas ang ginagamit, lahat ng mga ito ay nakakaugnay sa isang tiyak na paraan sa bawat isa.
Ang yunit ng katigasan ay kinukuha bilang tigas ng tubig, sa 1 l na naglalaman ng 1 mmol na katumbas ng Ca 2+ o Mg 2+. Ang isang yunit ng katigasan (1 mmol / L) ay tumutugma sa nilalaman ng mga ion ng calcium na katumbas ng 20.04 mg / L o magnesium ions na katumbas ng 12.15 mg / L. Ang kabuuang tigas ng tubig (H) ay maaaring kalkulahin ng formula:
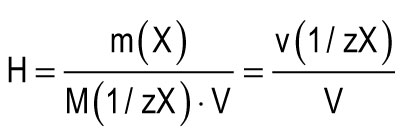
m (X) ay ang masa ng natunaw na sangkap, mg; Ang M (1 / zX) ay ang molar mass ng katumbas ng sangkap, mg / mmol (g / mol); Ang V ay ang dami ng tubig, l; M (1 / zCa 2+) \u003d 20.04 mg / mmol; M (1 / zMg 2+) \u003d 12.15 mg / mmol.
Bilang karagdagan, ang mga yunit ng paninigas tulad ng degree ng Aleman (˚d, dH), French degree ()f), American degree, at ppm ang CaCO 3 ay malawakang ginagamit sa mga dayuhang bansa.
Ang ratio ng mga yunit ng higpit na ito ay iniharap sa talahanayan. 1.
Talahanayan 1. Ang ratio ng iba't ibang mga yunit ng higpit
Kaya, ang isang degree sa Aleman ay tumutugma sa 10 mg / dm 3 CaO o 17.86 mg / dm 3 CaCO 3 sa tubig. Ang isang French degree ay 10 mg / dm 3 CaCO 3 sa tubig, at ang American degree ay katumbas ng 1 mg / dm 3 CaCO 3 sa tubig.
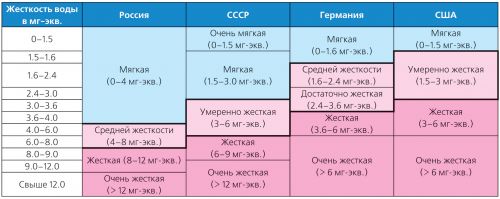
Ang tibok ng tubig ay nag-iiba nang malawak at maraming uri ng pag-uuri. Kaya, sa Alemanya, ang mga pamantayang mahigpit ng German Institute for Standardization (DIN 19643) ay inilalapat, at sa USA - ang pag-uuri na pinagtibay ng Environmental Protection Agency (USEPA) noong 1986 (Talahanayan 2).
Talahanayan 2. Pag-uuri ng iba't ibang uri ng higpit
Aling tubig ang mas malambot
Karaniwan, sa mga mababang mineralized na tubig, ang tigas ay namumuno dahil sa mga ion ng calcium (bagaman sa ilang mga bihirang kaso, ang tigas na magnesiyo ay maaaring umabot sa 50-60%). Sa pamamagitan ng isang pagtaas sa antas ng pangkalahatang mineralization ng tubig, ang nilalaman ng mga ion ng calcium (Ca 2+) ay mabilis na bumababa at bihirang lumampas sa 1 g / l. Ang nilalaman ng mga magnesium ion (Mg 2+) sa lubos na mineralized na tubig ay maaaring umabot ng ilang gramo, at sa mga lawa ng asin - sampu-sampung gramo bawat litro ng tubig.
Sa pangkalahatan, ang katigasan ng tubig sa ibabaw sa pangkalahatan ay mas mababa sa katigasan ng tubig sa lupa. Ang tigas ng tubig sa ibabaw ay napapansin sa napapanahong pagbagu-bago ng pana-panahon, kadalasang umaabot sa pinakamataas na halaga nito sa pagtatapos ng taglamig at pinakamababang panahon ng baha, kapag ito ay sagana na natunaw ng malambot na ulan at matunaw na tubig. Ang tubig sa dagat at karagatan ay may napakataas na tigas (sampu-sampu at daan-daang meq / l).
Mga kahihinatnan ng higpit
Ang matapang na inuming tubig ay mapait dahil sa lasa ng magnesiyo at may negatibong epekto sa sistema ng pagtunaw. Ayon sa mga pamantayan ng World Health Organization (WHO), ang pinakamainam na katigasan ng inuming tubig ay 1.0-2.0 mEq / l.
Ang mga produktong pagkain ay hindi mahuhukay sa mahirap na tubig, dahil ang mga cation ng calcium na may mga protina ng pagkain ay bumubuo ng mga hindi malulutas na compound; nabawasan ang kanilang nutritional value. Ang patuloy na paggamit ng matigas na tubig ay maaaring humantong sa pagpapatalsik ng mga asing-gamot (urolithiasis) sa katawan ng tao.
Ang tsaa at kape ay hindi maganda sa serbesa sa naturang tubig. Sa mga kondisyon sa domestic, ang labis na mga tigas na tigas ay humahantong sa pag-scale ng mga pag-init ng mga ibabaw sa mga boiler, teapots, pipes, ang pagpapalabas ng mga asing-gamot sa mga fixture ng pagtutubero at ang kanilang pagkabigo, mag-iwan ng isang deposito sa buhok at balat ng isang tao, na lumilikha ng isang hindi kasiya-siyang pakiramdam ng kanilang "katigasan".
Ang tigas ng tubig na ginamit upang maghanda ng iba't ibang mga produkto ay malinaw na kinokontrol at nasa antas ng 0.1-0.2 mEq / l.
Ang mga hard form ng tubig ay sukat sa mga dingding ng mga boiler ng pag-init, baterya, atbp.
Ang mga linya ng tubo ay napuno ng mga scale deposit ng labis na ang kanilang pagiging produktibo ay bumaba nang maraming beses. Samakatuwid, sa mga prosesong ito kung saan pinapayagan ang paggamit ng tubig na may isang tiyak na nilalaman ng asin, ang pagiging mahigpit nito ay limitado sa kahit na mas mababang mga halaga - 0.03-0.05 mEq / l.
Ang scale sa mga heaters ng washing machine ay naglalabas sa kanila ng pagkakasunud-sunod. Kapag naghuhugas, nakikipag-ugnay sa mga sangkap na aktibo sa ibabaw (surfactant) ng sabon o mga sabong labahan, ang mga tigas na tigas ay nagbubuklod sa kanila at nangangailangan ng higit na pagkonsumo. Hindi maaaring magamit ang matigas na tubig kapag isinasagawa ang ilang mga teknolohikal na proseso, halimbawa, sa panahon ng pagpipinta, sa electrochemistry, at iba pa.
Pag-alis ng asin
Ang mga proseso ng pagkuha ng Ca 2+ at Mg 2+ asing-gamot mula sa tubig sa paggamot ng tubig ay tinatawag na paglambot ng tubig.
Ang medyo napiling pagpili ng mga tigas na tigas mula sa tubig ay maaaring isagawa sa pamamagitan ng mga pamamaraan:
- paggamot ng init;
- paglilinis;
- reagent na paglambot;
- nagyeyelo;
- magnetic processing;
- pagproseso ng ultrasonic;
- pagpapalit ng ion;
- baligtad na osmosis.
Ang mga pamamaraan ng paggamot sa tubig ay kilala rin (mga electromagnetic effects, ang pagdaragdag ng polyphosphates o iba pang "anti-scale"), na pinapayagan na "magbigkis" ng tigas na mga asing-gamot, na pinipigilan ang mga ito mula sa pagbagsak sa anyo ng sukat sa loob ng ilang oras. Gayunpaman, ang mga pamamaraan na ito ay hindi neutralisahin neutralisahin ang mga tigas na tigas, huwag talagang alisin ang mga ito, at samakatuwid ay natagpuan ang limitadong paggamit sa paggamot ng pang-industriya na tubig.
Pagpapalambot ng thermal
Sa ganitong paraan, inaalis nila ang pansamantalang higpit na dulot ng calcium at magnesium bicarbonates. Kapag kumukulo ng tubig, ang mga hydrocarbons ay mabulok upang mabuo ang isang daluyan ng daluyan o pangunahing carbonate:
Ca (HCO 3) 2 \u003d CaCO 3 ↓ + CO 2 + H 2 O,
Mg (HCO 3) 2 \u003d Mg 2 (OH) 2 CO 3 ↓ + 3CO 2 + H 2 O.
Bilang isang resulta, ang katigasan ng tubig ay nabawasan. Iyon ang dahilan kung bakit ang bicarbonate na katigasan ay tinatawag na pansamantalang.
Sa mga iron iron, ang reaksyon ay mas kumplikado dahil sa ang katunayan na ang FeCO 3 ay isang hindi matatag na sangkap sa tubig. Sa pagkakaroon ng oxygen, ang dulo ng produkto ng reaksyon chain ay Fe (OH) 3, na isang madilim na pulang pag-ayos. Samakatuwid, ang mas bakal sa tubig, mas malakas ang kulay sa sukat, na idineposito sa mga dingding at ilalim ng daluyan habang kumukulo.
Kaya, kapag kumukulo ng tubig sa pang-araw-araw na buhay, ang proseso ng bahagyang paglambot nito ay sabay na nangyayari.
Pagwawakas
Ang pagdidilaw ay isang tradisyonal, mabisa at maaasahang pamamaraan na nagbibigay ng isang mataas na antas ng paglilinis ng mataas na tubig-alat ng asin na may mataas na kaasinan at katigasan.
Ang pangkalahatang prinsipyo ng pagkuha ng tubig sa pamamaraang ito ay ang mga sumusunod: ang pre-handa na inuming tubig ay pumapasok sa distiller, na binubuo ng tatlong pangunahing sangkap: isang evaporator, isang pampalapot, at isang maniningil.
Ang evaporator na may tubig ay pinainit sa isang pigsa. Ang singaw ng tubig ay pumapasok sa pampalapot, kung saan sila ay likido at sa anyo ng pag-distillate ay pumasok sa kolektor. Ang lahat ng mga hindi pabagu-bago na mga dumi na naroroon sa mapagkukunan ng tubig ay nananatili sa distiller.
Upang makakuha ng dalisay na tubig, ginagamit ang mga distiller, na naiiba sa bawat isa sa paraan ng pag-init, pagiging produktibo at mga tampok ng disenyo.
Ang pamamaraan ng nag-iisang distillation ay hindi pangkabuhayan, dahil kapag ginamit ito, may mga mataas na gastos sa enerhiya para sa pagpainit at pagsingaw (mga 3000 kJ bawat 1 kg ng singaw), pati na rin ang pagkonsumo ng tubig para sa paghataw ng singaw (mga 8 litro ng tubig 1 kg ng singaw). Samakatuwid, ang paggamit ng isang pag-distillation ay ipinapayong para sa mababang pagkonsumo ng tubig - 10-20 l / h.
Ang mas mahusay at matipid kaysa sa maginoo distillation ay ang mga high-na pagganap na mga haligi ng haligi. Ngunit ang mga ito ay lubos na mahal, bilang karagdagan, ang mga gastos ng pre-paggamot ng tubig para sa kanila ay mataas.
Ito ay nagkakahalaga na tandaan na ang pamamaraan ng distillation ay nagtatanggal ng lahat ng natunaw na asing-gamot sa pinagmulang tubig.
Reagent Application
Mayroong paglambot ng tubig sa pamamagitan ng paglilimita, soda-liming at soda-sodium na paraan ng paglambot ng tubig.
Kapag nililimitahan, ang hydrated dayap Ca (OH) 2 ay idinagdag sa solusyon sa isang pH na tungkol sa 10. Bilang isang resulta, ang mga reaksyon ay nagpapatuloy:
Ca (HCO 3) 2 + Ca (OH) 2 \u003d 2 CaCO 3 + 2H 2 O,
Mg (HCO 3) 2 + 2Ca (OH) 2 \u003d Mg (OH) 2 + 2Сaa 3 + 2Н 2 O.
Ang pamamaraang ito ay ginagamit para sa mataas na carbonate at mababang di-carbonate na tigas ng tubig, kung kinakailangan ang isang sabay na pagbaba sa tigas at kaasinan. Ang natitirang higpit ay 0.4-0.8 mEq / L na mas mataas kaysa sa hindi carbonate na higpit.
Kapag idinagdag ang soda dayap, ang slaked dayap Ca (OH) 2 at soda Na 2 CO 3 ay idinagdag sa tubig sa isang PH ng tungkol sa 10. Bilang resulta, nagaganap ang mga sumusunod na reaksyon:
Ca (HCO 3) 2 + Ca (OH) 2 + Na 2 CO 3 \u003d 2 CaCO 3 + 2NaOH + H 2 CO 3,
Mg (HCO 3) 2 + 2NaOH \u003d Mg (OH) 2 + 2NaHCO 3.
Tulad ng sumusunod mula sa mga equation ng reaksyon, sa proseso ng pagbuo at sedimentation ng sediment mula sa tubig, ang mga tigas na tigas ay nakuha. Kasama sa kanila, ang mga kolokyal at suspendido na mga particle na may kaugnay na polusyon ay tinanggal. Ang organikong sediment ay bahagyang nasasaktan sa mga kislap ng sediment.
Sa liming ng soda, dahil sa labis na mga ion ng HCO 3, ang higit na pagkumpleto ng pagtanggal ng mga tigas na tigas mula sa tubig ay nakamit. Ang pagtaas ng temperatura sa 70-80 ° C ay nagbibigay-daan sa iyo upang dalhin ang natitirang higpit sa 0.35-1.0 mEq / L. Ang parehong resulta ay maaaring makamit sa pamamagitan ng pagtaas ng mga dosis ng reagents.
Pamamaraan ng Soda Soda
Ang pagdaragdag ng soda ay kinakailangan kung ang hindi tigas na karbonat ay mas malaki kaysa sa carbonate. Kung ang mga parameter na ito ay pantay, ang pagdaragdag ng soda ay maaaring hindi kinakailangan.
Ang mga hydrocarbonates ng kaltsyum at magnesiyo bilang reaksyon sa form ng alkali ay hindi maayos na natutunaw na mga compound ng calcium at magnesium, soda, tubig at carbon dioxide:
Ca (HCO 3) 2 + 2NaOH \u003d CaCO 3 ↓ + Na 2 CO 3 + 2H 2 O,
Mg (HCO 3) 2 + 2NaOH \u003d Mg (OH) 2 ↓ + Na 2 CO 3 + H 2 O + CO 2.
Ang carbon dioxide na nabuo bilang isang resulta ng reaksyon ng magnesium hydrogen carbonate na may alkali ay gumanti muli sa alkali upang makabuo ng soda at tubig:
CO 2 + NaOH \u003d Na 2 CO 3 + H 2 O.
Hindi carbonate katigasan
Ang sulfate at calcium chloride ay gumanti sa soda na nabuo sa mga reaksyon ng tigas na carbonate at alkali at idinagdag ang soda upang mabuo ang calcium carbonate na hindi nakadikit sa mga kondisyon ng alkalina:
CaCl 2 + Na 2 CO 3 \u003d CaCO 3 ↓ + 2NaCl,
CaSO 4 + Na 2 CO 3 \u003d CaCO 3 ↓ + Na 2 KAYA 4.
Magnesiyo sulpate at klorido ay gumanti sa alkali upang makabuo ng magnesium hydroxide na pinalubog:
MgSO 4 + 2NaOH \u003d Mg (OH) 2 ↓ + Na 2 KAYA 4,
MgCl 2 + 2NaOH \u003d Mg (OH) 2 ↓ + 2NaCl.
Dahil sa katotohanan na sa mga reaksyon ng bicarbonate na may alkali, nabuo ang soda, na kasunod nito ay tumugon sa katigasan ng di-carbonate, ang halaga nito ay dapat na maiugnay sa ratio ng carbonate (LFA) at hindi-carbonate (LFA) na tigas:
- kung sila ay pantay-pantay, maaaring alisin ang soda;
- sa ilalim ng kundisyon Lc\u003e Lnc, ang isang labis na soda ay nabuo;
- na may ratio ng LCD< Жнк - недостаток соды и ее необходимо добавлять.
Ang mga proseso ng pag-aalis ay isinasagawa sa mga tanke ng sedimentation at mga clarifier na may isang suspendido na sediment layer.
Ang mga tanke ng sedimentation ay hindi epektibo at ang hypoksida na sapal na nakuha sa mga ito ay may mataas na halumigmig na 97-99%. Samakatuwid, sila ay kasalukuyang hindi gagamitin.
Sa pagsasagawa, ginagamit ang iba't ibang mga bersyon ng mga clarifier na may isang suspendido na sediment layer. Sa kanila, ang solusyon na linisin ay ibinibigay mula sa ibaba at dumaan sa sediment layer. Pinatataas nito ang koepisyent ng paglilinis ng tubig.
Ang mga pamamaraan ng reagent ay hindi ginagamit sa paghahanda ng inuming tubig. Matapos ang mga ito, ang tubig ay may malakas na reaksyon ng alkalina. Samakatuwid, ang mga reagents ay malawakang ginagamit sa enerhiya at industriya bilang unang yugto ng paglilinis sa mga mechanical filter. Kapag nagtatrabaho nang sama-sama, pinapayagan ka nitong mapahina ang tubig, alisin ang mga nasuspinde na solido, kabilang ang mga colloid, at bahagyang linisin ang tubig mula sa mga organikong sangkap.
Nagyeyelo
Upang labanan ang patuloy na tigas ng tubig, ginagamit ang isang pamamaraan tulad ng nagyeyelong yelo. Upang gawin ito, kailangan mo lamang na unti-unting i-freeze ang tubig. Kung humigit-kumulang na 10% ng likido ang nananatiling mula sa paunang halaga, kinakailangang alisan ng tubig ang hindi naka-frozen na tubig, at ibalik sa tubig ang yelo. Ang lahat ng mga asing-gamot na bumubuo ng katigasan ay nananatili sa tubig na walang baso.
Kasabay ng pag-distillation, ito ay kasabay ng isa sa mga paraan upang mailarawan ang lubos na tubig ng asin sa potable na kalidad.
Iba pang mga pamamaraan
Ang pamamaraan ng electrodialysis ay batay sa hindi pangkaraniwang bagay ng direktang paggalaw ng mga electrolyte ions sa mga electrodes na konektado sa isang direktang kasalukuyang network. Kaya, ang mga metal ion, na tumutukoy sa tigas ng tubig, ay nakulong sa mga electrodes at nahihiwalay mula sa tubig na nag-iiwan ng aparatong paggamot ng tubig.
Ginagamit din ang magnetic na paraan ng pag-ionization ng hindi pangkaraniwang bagay ng direktang paggalaw ng mga ions, ngunit nasa ilalim ng impluwensya ng isang magnetic field. Upang madagdagan ang bilang ng mga ions sa tubig, ito ay preliminarily irradiated na may ionizing radiation.
Ang magnetikong paggamot ng tubig ay binubuo sa pagpasa ng tubig sa pamamagitan ng isang sistema ng magnetic field ng kabaligtaran na direksyon. Bilang isang resulta nito, mayroong pagbaba sa antas ng hydration ng mga natunaw na sangkap at ang kanilang kumbinasyon sa mas malalaking mga partido na umuunlad.
Ang paggamot ng Ultrasonic ng tubig ay humahantong din sa pagbuo ng mas malaking mga particle ng mga natunaw na sangkap na may pagbuo ng sediment.
Maipapayo na isaalang-alang ang pamamaraan ng pagpapalitan ng ion at detalyadong mga proseso ng osmosis nang detalyado sa ikalawang bahagi ng artikulo, na ilalathala namin sa aming journal sa susunod na isyu.
