Duritatea apei și eliminarea acesteia. Sarcini și exerciții pentru metale ale subgrupului iA
Pagina 1
Eliminarea durității temporare se realizează prin apă clocotită. La fierbere, hidrocarbonatele sunt distruse și carbonatele slab solubile formate precipită. Când carbonatul de sodiu, hidroxidul de calciu este introdus în apă, duritatea totală a apei este îndepărtată. În acest caz, duritatea carbonatului este eliminată prin var, iar duritatea necarbonată este eliminată prin sodă.
Pe lângă eliminarea durității temporare, varul precipită tot din magneziu și fier din apă și promovează coagularea coloidelor organice și anorganice.
După curățarea impurităților, eliminând duritatea și dezaerarea temporară, apa de machiaj este introdusă în schimbătorul de căldură (2), unde este încălzită la 335 K. După amestecare, apa de machiaj și retur este pompată în a doua zonă a schimbătorului de căldură (2), unde este încălzită la 355 K și se varsă în rețele de încălzire
Înmuierea este adesea folosită pentru a elimina duritatea temporară a apei, concepută pentru a compensa pierderile (reîncărcarea) în sistemele închise de alimentare cu apă și pentru a preveni murdărirea minerală a suprafețelor de schimb de căldură și răcire în contact cu apa care circulă. În multe cazuri, apa de machiaj este principala sursă de acumulare a ionilor de calciu și a biocarbonatelor în apa reciclată, care în sistemele cu coeficienți mari de evaporare pot perturba compoziția stabilă a apei reciclate.
Înmuierea apei pentru a elimina duritatea temporară se realizează chimic prin introducerea de reactivi, care sunt folosiți sub formă de var, acid sulfuric sau clorhidric. Metodele chimice realizează o înmuiere relativ mică a apei. Pentru un grad mai mare de înmuiere, se folosesc metode de schimb de cationi, a căror esență este utilizarea capacității anumitor substanțe de a schimba cationii de sodiu conținute în ele pentru cationii sărurilor de duritate din apă.
Soda caustică este utilizată în centralele termice pentru a elimina duritatea temporară a apei, pentru regenerarea filtrelor anovitice utilizate în plante pentru desalinizarea chimică a apei.
Soda caustică este utilizată în centralele termice pentru a elimina duritatea apei temporare și pentru a regenera filtrele anionice utilizate în uzinele de desalinizare chimică.
În mod similar, trebuie calculată și cantitatea de Ca (OH) 2 necesară pentru a elimina rigiditatea temporară.
De ce, pentru a elimina rigiditatea temporară datorată sărurilor de magneziu, este nevoie de mai mult var decât de a elimina rigiditatea temporară datorată sărurilor de calciu.
Prin urmare, pentru a reîncărca sisteme de alimentare cu apă închise (fără purjare), ar trebui să se realizeze o înmuiere relativ profundă a apei de machiaj și eliminarea durității temporare.
Introducerea unor cantități mici de reactivi alcalini crește eficiența tratamentului magnetic al apei, deși introducerea de reactivi alcalini, de exemplu, var în cantități de cel mult 10 - 20% din cele necesare pentru a elimina rigiditatea temporară, conform studiilor efectuate la KhIEI în 1959, reduce formarea la scară De 8 până la 10 ori.
În acest caz, apa cu șase oase cauzată de bicarbonati este eliminată. Prin urmare, această rigiditate este numită temporară sau bicarbonat. Prin urmare, pentru a elimina rigiditatea temporară, este suficient să fierbeți apa.
Sărurile de duritate constantă, de exemplu, CaCl, CaSO4 etc. nu sunt eliminate din apă atunci când sunt încălzite. Sunt precipitate în timpul evaporării apei, formându-se pe pereții aparatului greu de îndepărtat la scară densă. Apa tare poate fi utilizată numai în cazurile în care condițiile de utilizare a acesteia nu provoacă precipitații ale precipitațiilor solide, de exemplu, în frigiderele în care apa de răcire nu se încălzește până la o temperatură care ajută la eliminarea durității temporare. În instalațiile de cazane, unde apa nu numai că se încălzește, ci se evaporă, nu numai temporar, dar și duritatea constantă este inacceptabilă. Prin urmare, apa pentru ele este purificată preliminar din săruri de calciu și magneziu printr-o metodă chimică în plante speciale.
Instituție de învățământ municipal
„Școala gimnazială numărul 1
cu studiu aprofundat al subiecților individuali
Adresa: Regiunea Belgorod,
Test de duritate a apei
și modalități de a-l elimina
student 11 "A" clasa MOU "Media
școala secundară numărul 1
cu studiu aprofundat
obiecte individuale
Adresa: Regiunea Belgorod,
Consilier științific:,
profesor de chimie
școala secundară numărul 1
cu studiu aprofundat
obiecte individuale
novy Oskol, Regiunea Belgorod
Adresa: Regiunea Belgorod,
novy Oskol,
novy Oskol
1. Introducere ……………………………………………………………………………… .3
2. Duritatea apei și metodele de eliminare a acesteia …………………………… .4
· De ce apa devine tare .......................................
· Valoarea durității apei în viața omului ...................................... 4
· Modalități de eliminare a rigidității …………………………………………… ... 5
3. Studiul durității apei și a metodelor de eliminare a acesteia ............... 8
4. Concluzii și concluzii
5. Lista referințelor
introducere
Cine a studiat științele, dar nu le aplică,
similar cu cel care a aratat, dar nu semăna.
Saadi
În anii 80 ai secolului XX, cărțile lui Paul Chappius Bragg au apărut pe promovarea unui stil de viață sănătos. Și deși mulți savanți consideră opinia lui controversată, cărțile lui Paul Bragg merită atenție. Una dintre secțiunile cărții sale (Primele mele experimente cu duritate) este dedicată problemei durității apei, în care autorul din memoriile sale descrie boala bunicului său, care a murit din cauza faptului că vasele sale de sânge au devenit petrificate din apa tare și femeia care a trăit în părțile lor ( nefericita femeie a fost numită femeie de piatră, deoarece corpul ei a fost literalmente petrificat de un număr mare de săruri). Acea femeie a fost una dintre numeroasele victime ale apei dure. Nefericitele autorități nu au reușit să facă față procesării unei cantități mari de substanțe anorganice conținute în astfel de apă și au început să se acumuleze foarte activ în corpul ei.
Compușii de calciu precipită în corpul nostru sub formă de pietre la rinichi și vezica biliară.
Astăzi, tratarea apei nu este un capriciu și răsfăț, ci mai degrabă o necesitate vitală. Faptul este că fenomene atât de neplăcute, cum ar fi spumă, mirosuri terțe, mirosuri, precum și prezența unui precipitat tulbure nu numai că provoacă multe neplăceri, dar provoacă multe boli. Apa de calitate scăzută promovează depunerea sărurilor, accelerează procesul de îmbătrânire a organismului și devine cauza tranziției multor boli la stadiul cronic. În plus, clorul conține o serie de substanțe care pot provoca cancer. Dar apa este baza întregii vieți și nu un singur organism viu nu se poate descurca fără apă. De exemplu, o persoană constă din apă la 60-65%. Prin urmare, apa curată este vitală pentru fiecare persoană. Din păcate, apa naturală din vremea noastră este complet improprie consumului fără tratament preliminar, lucru confirmat prin diverse analize ale apei. Toată lumea știe că stațiile de filtrare, care se presupune că efectuează purificarea apei, au nevoie de mult timp de reparații majore, iar sistemele de alimentare cu apă prin care este livrată apă în casele noastre necesită înlocuire.
Scopul activității noastre a fost să studiem nivelul de duritate a apei din orașul nostru natal.
Duritatea apei și metodele de eliminare a acesteia
De ce apa devine greu
Calciul și compușii săi sunt foarte necesari pentru organism: la urma urmei, din ortofosfatul de calciu Ca3 (P04) 2 este compus oasele și dinții oamenilor și animalelor. Sunt formate din compuși solubili de calciu, care transportă sânge în tot corpul. Datorită cationilor de calciu Ca2 +, sângele este capabil să se coaguleze, formând cheaguri, înfundarea rănilor și oprirea sângerării.
Compușii de calciu sunt nu numai utili, ci și foarte nocivi - de exemplu, când dau duritate apei obișnuite. În viața de zi cu zi, cuvântul „rigiditate”, la prima vedere, poate fi aplicat numai pe solide: o bancă din parc sau un taburet în bucătărie pot fi solide. Cu toate acestea, apa este și ea grea.
Sursa principală de săruri de magneziu și calciu care intră în apă sunt depozitele de calcar, gips și dolomit care sunt erodate de apele naturale.
În apele saline scăzute, majoritatea ionilor de calciu. Odată cu creșterea gradului de mineralizare, conținutul de ioni de calciu scade rapid și depășește rar 1 g / l. Conținutul de ioni de magneziu în apele mineralizate poate atinge câteva grame, iar în apele sărate câteva zeci de grame.
Duritatea apei - o combinație de proprietăți chimice și fizice ale apei asociate cu conținutul de săruri dizolvate de metale alcaline din pământ, în principal calciu și magneziu. Apa cu un conținut ridicat de astfel de săruri se numește apă tare, cu un conținut scăzut - moale. Există rigiditate temporară (carbonat) formată din hidrocarburați și rigiditate permanentă (necarbonată) cauzată de prezența altor săruri. Rigiditatea temporară se datorează prezenței bicarbonatelor de calciu și magneziu (Ca (HCO3) 2; Mg (HCO3) 2) în apă. Duritatea constantă a apei se datorează prezenței în apă a sulfaților, clorurilor de Ca și Mg (CaSO4, CaCl2, MgSO4, MgCl2).
Valoarea durității apei în viața omului
Duritatea apei este suma ionilor de calciu Ca2 + și magneziu Mg2 + dizolvați în apă.
Ionii de calciu și magneziu nu fac prea mult rău organismelor vii, dar prezența lor în apă în cantități mari nu este de dorit, deoarece o astfel de apă nu este potrivită pentru nevoile gospodăriei.
În apa tare, consumul de săpun și pulbere crește atunci când se spală rufe, carne și legume sunt digerate lent, iar motilitatea stomacului este redusă. Apa tare nu este potrivită pentru sistemele de alimentare cu apă și echipamentele de încălzire a apei.
Duritatea se măsoară în miligrame echivalente pe litru (mEq / L). Standardele industriale pentru valorile de rigiditate admise depind de tipul de echipament utilizat. De obicei, este considerată apă tare cu o duritate de 1 mEq / L sau mai mult.
Duritatea este cea mai frecventă problemă a calității apei. Inițial, termenul „apă tare” a fost aplicat apei dificil de spălat.
Apa tare, când este spălată, usucă pielea, spuma este slab formată în ea atunci când folosești săpun. Utilizarea apei dure determină să apară sedimente (scară) pe pereții cazanelor, în țevi etc. În același timp, utilizarea apei prea moi poate duce la coroziunea conductelor, deoarece, în acest caz, nu există o tamponare acid-bază furnizată de hidrocarbonat rigiditate (temporară). Consumul de apă tare sau moale nu este de obicei periculos pentru sănătate, deși există dovezi că o rigiditate ridicată contribuie la formarea de pietre urinare, în timp ce duritatea scăzută crește ușor riscul de boli cardiovasculare.
Duritatea apelor naturale poate varia destul de mult și este instabilă pe tot parcursul anului. Duritatea crește datorită evaporării apei, scade în timpul sezonului ploios, precum și în timpul topirii zăpezii și gheții.
Modalități de a elimina rigiditatea
distinge global rigiditate, care este compusă din temporar și permanent.
Fierbere.
temporar rigiditatea (de unică folosință sau carbonat) se datorează prezenței bicarbonatelor de Ca (HCO3) 2 și Mg (HCO3) 2. Duritatea carbonului ușor de îndepărtat apă clocotităîn care Ca2 + și Mg2 + sunt îndepărtate pentru a forma precipitate insolubile:
Ca (HCO3) 2 CaCO3 ↓ + CO2 + H2O
Ionii Mg se precipită sub formă de carbonat de bază sau sub formă de hidroxid de magneziu (la pH\u003e 10,3).
2Mg2 + + OH) 2CO3 ↓ + CO2 + H2O
(Ioni OH se formează datorită interacțiunii ionilor cu apa: iar echilibrul se schimbă spre dreapta atunci când este încălzit).
Pentru a reduce duritatea carbonatului metoda liming-ului în care se introduce apa tratată teiCa (OH) 2. Reacțiile care au loc cu introducerea varului pot fi scrise sub formă moleculară:
Ca (HCO3) 2 + Ca (OH) 2 → 2CaCO3 ↓ + H2O
Mg (НСО3) 2 + Са (ОН) 2 → Mg (ОН) 2 ↓ + 2СаСО3 + Н2О
Duritatea constantă (nerecuperabilă sau necarbonată) este menținută atunci când apa este fiartă, deoarece duritatea constantă se datorează prezenței în apă a sulfaților, clorurilor și a altor săruri de Ca și Mg. Cantitativ, este egal cu concentrația ionilor de Ca2 + și Mg2 + minus duritatea timpului. Folosit de obicei pentru a reduce duritatea carbonatului. sifon bicarbonat de sodiu (Na2CO3):
MgSO4 + Na2CO3 → MgCO3 ↓ + Na2SO4
În timp ce adăugați evacuare și sifon puteți scăpa de duritate de carbonat și non-carbonat ( metoda var-sodă).
Toată rigiditatea este eliminată chiar și cu administrare fosfat de sodiu, tetraborat de sodiu Și altele, deoarece ortofosfații sunt mai puțin solubili decât carbonatele, utilizarea lor în înmuierea apei este mai convenabilă:
3CaSO4 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 3Na2SO4
Modul modern de înmuiere a apei se bazează pe utilizare rășini schimbătoare de ioni - schimbătoare de ioni (schimbătoare de cationi și schimbătoare de anioni). Schimbătorii de cationi sunt rășini sintetice pentru schimb de ioni - aluminosilicați, de exemplu:
Compoziția lor poate fi exprimată condițional prin formula generală Na2R, în care Na + este un cation extrem de mobil și R - este o particulă schimbătoare de cationi care poartă o încărcare negativă.
Când apa tare curge printr-un strat de rășină schimbătoare de cationi, cationii sunt schimbați în funcție de reacțiile:
Ca2 + + Na2R → 2Na + + CaR
Mg2 + + + Na2R → 2Na + + MgR
Astfel, ionii Ca2 + și Mg2 + trec de la soluție la rășina schimbătoare de cationi. Pentru a restabili rășina schimbătoare de cationi, se spală cu o soluție concentrată de NaCl:
CaR + 2NaCl → CaCl2 + Na2R
După spălare, rășina schimbătoare de cationi poate fi din nou folosită pentru a îndepărta rigiditatea din apă.
Osmoza inversă. Metoda se bazează pe trecerea apei prin membrane semipermeabile (de obicei poliamidă). Împreună cu sărurile de duritate, sunt eliminate și cele mai multe alte săruri. Eficiența de curățare poate ajunge la 99,9%. Această metodă a găsit cea mai mare aplicație în sistemele menajere de tratare a apei potabile. Ca dezavantaj al acestei metode, trebuie remarcată necesitatea pregătirii prealabile a apei furnizate membranei cu osmoză inversă.
Electrodializă. Se bazează pe eliminarea sărurilor din apă prin acțiunea unui câmp electric. Eliminarea ionilor de substanțe dizolvate are loc datorită membranelor speciale. Ca și în cazul tehnologiei de osmoză inversă, alte săruri sunt eliminate, pe lângă ioni de duritate.
Metoda termică. Pe baza încălzirii cu apă, elimină doar rigiditatea temporară (carbonat). Găsește aplicația în viața de zi cu zi. În industrie este folosit, de exemplu, la centralele termice.
Înmuierea reactivilor Metoda se bazează pe adăugarea de sodă sau var tăiat în apă. În acest caz, sărurile de calciu și magneziu trec în compuși insolubili și, ca urmare, precipitați. Această metodă este justificată la consumul relativ mare de apă, deoarece este asociată cu soluționarea mai multor probleme specifice: filtrarea nămolului, dozarea exactă a reactivului.
schimb de cationi. Metoda se bazează pe utilizarea încărcării granulare cu schimb de ioni (cel mai adesea rășini schimbătoare de ioni). Un astfel de contact, la contactul cu apa, absoarbe cationii sărurilor de duritate (calciu și magneziu). În schimb, în \u200b\u200bfuncție de forma ionică, oferind ioni de sodiu sau hidrogen. Aceste metode sunt denumite respectiv cation Na și cation H. De regulă, duritatea apei scade cu o cationizare cu sodiu într-o singură etapă până la 0,05-0,1 mEq / L, cu două etape - până la 0,01 mEq / L.
Cel mai bun reactiv Pentru a elimina duritatea generală a apei, otofosfat de sodiu este Na3PO4: 3Ca (HCO3) 2 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 6NaHCO3 3MgSO4 + 2Na3PO4 → Mg3 (PO4) 2 ↓ + 3Na2SO4 Calciu și magneziu ortofosfat o mai bună înmuiere a apei. În industrie, folosind filtre de schimb de ioni, ionii de calciu și magneziu sunt înlocuiți de ioni de sodiu și potasiu pentru a produce apă moale. O anumită înmuiere a apei are loc în filtrele menajere pentru apa potabilă. Apa filtrată dă o cantitate mai mică. Apa poate fi complet purificată prin distilare (distilare).
Astăzi sunt excelente filtre de apă care sunt instalate în apartament fără probleme și servesc ca un instrument excelent pentru tratarea apei de înaltă calitate. Poate că mulți preferă astăzi să cumpere apă purificată îmbuteliată în supermarketuri. Alegerea unei astfel de ape este cu adevărat uriașă, dar este posibil să fii 100% sigur de calitatea sa? Poate că nu! De aceea, purificarea apei cu ajutorul unor filtre special concepute pentru purificare este cea mai optimă soluție pentru o persoană modernă, care are grijă de sănătatea sa și de sănătatea celor dragi. Sistemele de purificare a apei sunt foarte diverse. De regulă, acestea diferă: performanța, unii parametri, gradul de purificare a apei, precum și designul. Filtrele de apă curăță perfect apa și o fac potrivită pentru băut, reduce conținutul de aluminiu, fier, mangan, clor, toate tipurile de nitrați din ea. În plus, filtrele pentru purificarea apei ajută la eliminarea mirosului neplăcut, a gustului, precum și la scăparea germenilor și bacteriilor conținute în apă. Apa care a fost purificată prin astfel de sisteme devine mai puțin rigidă, cu toate acestea, nu pierde substanțe utile necesare organismului uman. Filtrele de apă sunt o oportunitate excelentă de a primi apă purificată în cantități nelimitate, fără a ieși de acasă. Un filtru selectat corespunzător va fi o soluție excelentă la problema apei curate, va îmbunătăți sănătatea și vă va extinde longevitatea.
Studiul durității apei și a metodelor de eliminare a acesteia
Duritatea apei se datorează prezenței ionilor de Ca2 + și Mg2 +. Cu cât conținutul lor este mai mare în apă naturală (apa care trece prin roci calcaroase și soluri), cu atât duritatea acesteia este mai mare.
Cantitativ, duritatea apei este exprimată ca suma dintre echivalenții ionilor de Ca2 + și Mg2 + conținuți într-un litru de apă (meq / l). Un miliequivalent de duritate corespunde unui conținut de 20,04 mg / L de ioni Ca2 + sau 12,16 mg / L de Mg2 +.
Prin urmare, atunci când rezolvați probleme, puteți utiliza formula:
(mmol - echiv / l),
unde m - masa substanței care determină duritatea apei sau folosită pentru a elimina duritatea apei, mg;
Mae- masa echivalentă a acestei substanțe, g / mol;
V- volumul de apă, l
Prin duritate, toate apele naturale sunt împărțite în moale(duritate totală mai mică de 2 mmol / l) și greucu un grad mediu de rigiditate (2-10 mmol / l) și un grad ridicat de rigiditate (mai mult de 10 mmol / l).
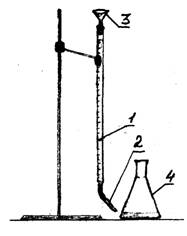
1 - biuretă
2 - picurator
3 - pâlnie
Figura 1 - Configurare experimentală
Experiență de performanță
În trei baloane, măsurați cu un cilindru gradat mare 100 ml de apă. Adăugați 2-3 picături de indicator portocaliu de metil în fiecare balon cu apă. Titrarea se realizează 0,1 N. soluție de acid clorhidric folosind o biuretă. Setați nivelul acidului din buretă la divizare zero. Se toarnă acid clorhidric prin picurare până când culoarea soluției se schimbă de la galben la roz-portocaliu. Înregistrați cantitatea de acid intrată în titrare. Repetați titrarea încă de două ori. Introduceți datele în tabel.
Calculul se face după formula:
![]() (mmol - echiv / l),
(mmol - echiv / l),
unde este concentrația normală de acid clorhidric;
Vcp ( HCI) - volum mediu HCI, plecat pentru titrare;
Vwater - volumul de apă preluat pentru titrare.
Datele obținute le-am proiectat sub forma unui tabel.
Proba de apă
folosit pentru titrare
utilizat pentru titrarea apei filtrate
Apa de la robinet - cabinet de chimie
Apa de la robinet - st. aviație
Apa de la robinet - st. octombrie
Apa din coloană - p. Coastă
Apa de la robinet - st. Pokrovsky
Apa din puț. Pokrovsky
Apa de la robinet - st. Belgorod
Apa de la robinet - st. soldat
Soda de apă "Frumos"
În condițiile laboratorului școlar, am efectuat un studiu despre apa prelevată din diverse surse pentru duritate. Pentru a determina duritatea, s-a utilizat titrarea apei naturale cu acid clorhidric în prezența unui indicator de portocaliu. Duritatea carbonatului eșantionului de apă a fost determinată înainte și după trecerea ei printr-un filtru de uz casnic (a fost folosit Aquaphor).
În urma lucrărilor, s-au făcut următoarele concluzii:
1) Apa din orașul Novy Oskol este dură (W \u003d 7-10,5). Mulți oameni trăiesc în sectorul privat și folosesc apa din fântâni, iar această apă este foarte grea.
2) Apa care intră în alimentarea cu apă este supusă purificării și înmuierii (L \u003d 6-7), prin urmare, poate fi considerată duritate medie (conform GOST, duritatea totală a apei potabile nu trebuie să depășească 7 mmol / l).
3) Cea mai ușoară metodă de înmuiere a casei este fierberea în mod tradițional.
4) Experimentele au arătat că filtrele de uz casnic înmoaie perfect și apa. Deci, apa preluată pentru cercetare din fântâna de pe ul. Pokrovsky (duritate 10,5 mmol / L), după filtrare, a avut o duritate de numai 2 mmol / L, care este chiar mai mică decât norma fiziologică (3,5 mmol / L). Astfel, filtrele de apă sunt o oportunitate excelentă de a primi apă purificată în cantități nelimitate fără a părăsi casa.
Lista referințelor
1.,. un ghid pentru exerciții practice de igienă cu tehnica cercetării sanitare. - M.: „Medicină”, 19 ani.
2. și. Bazele analizei chimice. Ghid de studiu pentru studenți. - M .: „iluminarea”, 1971. - 192 p.
3. Chimie anorganică: manual. pentru tehnolog spec. universități. - M .: Mai mare. școală., 1989 .-- 432 p.
4 ,. Monitorizăm mediul orașului nostru: clasele 9-11: Atelier școlar. - M .: Umanitatea. ed. Centrul VLADOS, 2001. - 112 p.
5. Chimie: Ref. ed. / B. Schroeter, K.-H. Lautenschleger, H. Bibrak și colab .: Per. cu ea._ M.: Chimie, 1989. - Per. ed .: GDR, 1986.- 648 p.
Lanțuri de transformare
1. Carbonat de calciu Oxid de calciu Hidroxid de calciu Nitrat de calciu Carbonat de calciu.
2. Sulfat de magneziu Nitrat de magneziu Oxid de magneziu Acetat de magneziu.
3. Clorură de calciu sulfat de calciu sulfat de calciu sulfat de calciu sulfat de calciu hidroxid de calciu oxid de calciu hidrocarbonat de calciu.
4. Oxid de magneziu Magneziu Hidroxid de magneziu Clorură de magneziu Hidroxocarbonat de magneziu Sulfat de magneziu Hidroxid de magneziu.
5. Sulfat de magneziu Oxid de magneziu ... hidroxid de magneziu ... nitrat de magneziu.
6. Calciu Hidroxid de calciu Carbonat de calciu Oxid de calciu Carbur de calciu Hidroxid de calciu Hidrocarbonat de calciu.
Sarcini de decontare
Nivelul A
1. Interacțiunea de 13,7 g de metal cu apa degajă 2,24 litri de gaz (n.a.). Identificați metalul. Ce precipitat și în ce cantitate se formează dacă la soluția rezultată se adaugă un exces de sulfat de sodiu?
decizie
Gazul (H2) este eliberat în timpul interacțiunii subgrupurilor M Ia și IIa cu apa.
Conform legii echivalentelor:
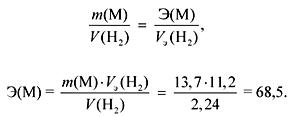
Dacă M Ia subgrupuri, atunci
A r (M) \u003d valența E \u003d 68,5 (fără un astfel de metal).
Dacă M IIa subgrupe, atunci
A r (M) \u003d E valență \u003d 137 (Ba).
Ba + 2H2O \u003d Ba (OH) 2 + H2,
Ba (OH) 2 + Na2S04 \u003d BaSO4 + 2NaOH,
(BaSO 4) \u003d (Ba (OH) 2) \u003d (Ba) \u003d\u003d 0,1 mol,
m(BaSO 4) \u003d M\u003d 0,1 233 \u003d 23,3 g.
Răspunsul. Metal - Ba; m(BaSO 4) \u003d 23,3 g.
2. Ce volum de soluție de hidroxid de calciu 0,5 M trebuie adăugat la 81 g dintr-o soluție de 10% (densitate 1 g / cm3) de bicarbonat de calciu pentru a completa formarea de sediment? Determinați masa sedimentelor.
Răspunsul. 100 ml Ca (OH) 2, 10 g CaCO3.
3. Soluția care conține 23,3 g dintr-un amestec de sulfat de potasiu și cromat este afectată de un exces de clorură de bariu. Precipitatul a fost filtrat, spălat și apoi i s-a adăugat un exces de acid clorhidric. O parte din precipitat s-a dizolvat, partea rămasă a fost filtrată, spălată și uscată. Masa precipitatului după uscare a fost de 23,3 g. Determinați compoziția amestecului inițial.
Răspunsul. 17,4 g de K2S04 și 5,9 g de K2 CrO4.
4. Există un amestec de calciu, oxid de calciu și carbură de calciu cu un raport molar de componente de 1: 3: 4 (în ordinea listării). Ce volum de apă poate intra în interacțiune chimică cu 35 g de astfel de amestec?
Răspunsul. 17,568 ml.
5. Solubilitatea hidroxidului de stronțiu în apă la 100 ° C este de 28 g, iar la 25 ° C - 1 g la 100 g de apă. S-au răcit 200 g de soluție de hidroxid de stronțiu saturat la 100 ° C la 25 ° C. Găsiți masa hidroxidului de stronțiu octahidrat precipitat atunci când soluția a fost răcită.
Răspunsul. 93,08 g Sr (OH) 2 8H 2 O.
Nivelul B
1. O anumită masă de carbonat de magneziu cristalin a fost calcinată până la încetarea evoluției gazelor. Acestea din urmă au fost trecute prin sticle de spălare cu acid sulfuric concentrat și apă de var. Masa primului balon a crescut cu 1,8 g, iar în a doua, a scăzut 2 g de precipitat. Determinați compoziția hidratului cristalin de pornire și masa acestuia.
Răspunsul. MgCO3 5H2 O pentahidrat; 3,48 g
2. Raportul molar de carbonat, bicarbonat și azotat de calciu într-un amestec care cântărește 100 g este 1: 2: 3 (în ordinea listării). Ce volum la 1200 ° C și presiune normală vor lua produsele de descompunere gazoase ale acestui amestec?
decizie
Ecuațiile reacțiilor de descompunere ale componentelor amestecului:
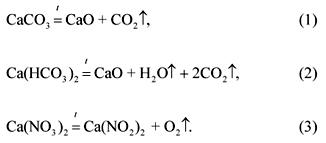
În funcție de starea problemei:
(CaCO 3): (Ca (HCO 3) 2): (Ca (NO 3) 2) \u003d 1: 2: 3.
Fie (CaCO 3) \u003d x alunița.
Atunci (Ca (HCO3) 2) \u003d 2 x;
(Ca (NU 3) 2) \u003d 3 x;
100x + 162 2x +164 3x \u003d100,
x 0,109 mol.
la r \u003d 101,3 kPa și t \u003d 1200 ° C în stare gazoasă, este eliberat:
CO 2 conform ecuației (1):
1 (CO2) \u003d (CaCO3) \u003d x \u003d 0,109 mol;
H2 O, CO 2 conform ecuației (2):
2 (H2O) \u003d (Ca (HCO3) 2) \u003d 2 x \u003d 0,218 mol,
2 (CO2) \u003d 2 (Ca (HCO3) 2) \u003d 4 x \u003d 0,436 mol;
O 2 conform ecuației (3):
3 (O 2) \u003d (Ca (NU 3) 2) \u003d 3 x \u003d 0,327 mol.
Numărul total de moli de produse de descompunere gazoase:
0,109 + 0,218 + 0,436 + 0,327 \u003d 1,09 mol (n.a.).
Din ecuația de stare a gazelor ideale găsim volumul:
pV = RT,
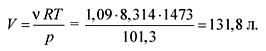
Răspunsul. V \u003d 131,8 litri
3. Un amestec de cantități egale de hidroxid de metal divalent și carbonat a fost calcinat. Masa reziduului solid s-a dovedit a fi de 1.775 ori mai mică decât masa amestecului inițial. La acest reziduu s-a adăugat de 10 ori o masă mare de soluție de acid sulfuric 5%. Calculați fracția în masă a substanțelor din soluția rezultată.
Răspunsul. 6% MgSO4.
4. Când apa este tratată cu un amestec de hidrură și nitrură dintr-un metal divalent cu fracții de masă egală, s-a format un amestec de gaz cu o densitate de hidrogen de 2,658. Setați metalul inclus în compuși (nu rotunjiți numerele la calcul!).
Răspunsul. Calciu.
5. O placă de magneziu de 16 g a fost aruncată într-o soluție de 16% sulfat de cupru (II) în greutate de 350 g. Când placa a fost îndepărtată, fracțiile de masă ale sărurilor conținute în soluție s-au dovedit a fi aceleași. De câte ori a crescut masa plăcii?
Răspunsul. De 4,5 ori.
Sarcini de calitate
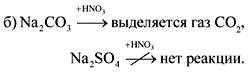
1. Care dintre aceste substanțe vor interacționa cu hidroxidul de magneziu: acid clorhidric, acid azotic, dioxid de carbon, clorură de sodiu, hidroxid de bariu, acid sulfuric, oxid de cupru (II)?
Răspunsul. HCl, HNO3, H2S04.
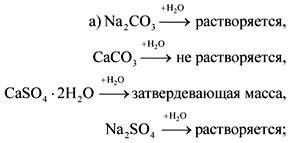
2. În sticlele fără etichete sunt sodă, cretă, ipsos și sulfat de sodiu. Cum pot fi recunoscute aceste substanțe cu apă și acid azotic?
Răspunsul.
3. Substanța A este un metal ușor, destul de dur, alb-argintiu. În interacțiunea substanței A cu B, care este o substanță gazoasă simplă, se formează compusul C, care este solubil în apă pentru a forma o soluție alcalină. La prelucrarea substanței Cu acid sulfuric, se formează sare, al cărui hidrat cristalin este utilizat în medicament pentru aplicarea pansamentelor fixative pentru fracturi. Dă ecuațiile de reacție.
Răspunsul. A este Ca; B este H2; C este CaH2; hidrat cristalin - CaSO 4 2H 2 O.
4. Substanța A este un oxid solubil în apă pentru a forma o soluție alcalină. Compusul B din această soluție reacționează cu gazul inodor C pentru a forma un precipitat alb, care se dizolvă treptat pe măsură ce gazul C. trece mai departe. Dă ecuațiile de reacție și identifică substanțele.
Răspunsul. A este CaO, BaO; B este Ca (OH) 2, Ba (OH) 2; C este CO2.
5. Substanța A, care face parte dintr-unul dintre cele mai comune minerale din scoarța terestră, se descompune la temperatură ridicată în doi oxizi, dintre care unul B este întotdeauna format în procesul vieții. Când substanța B interacționează cu grafitul, atunci când este încălzit, gazul C, care este toxic pentru animalele cu sânge cald, este inflamabil, incolor și inodor. Dați ecuațiile reacțiilor, identificați substanțele.
Răspunsul. A - CaCO3; B este CO2; C - CO.
Duritatea apei și eliminarea acesteia
Rezumat chimie
subiect:„Duritatea apei”
Antreprenor de lucrări:Grabin Pavel.
plan
Introducere 3
Determinarea durității apei. 3
Tehnici de rigidizare 4
Referințe 6
introducere
În peșteri, peșterile se întâlnesc cu cele mai frumoase formațiuni calcaroase - stalactite agățate de arcade și stalagmite cresc în sus. Din punct de vedere al chimiei, apariția acestor creații uimitoare ale naturii este rigiditatea apelor subterane. Întâlnim conceptul de duritate a apei nu numai în speologie și geologie, ci, în general, peste tot - în chimie, tehnologie și chiar în viața de zi cu zi. Prin urmare, acest concept este foarte important pentru determinarea calității apei.
Determinarea durității apei
Duritatea apei - proprietatea apei (care nu trebuie spălată, pentru a da scară în cazanele cu aburi) asociată cu conținutul de compuși de calciu și magneziu solubile în acesta, acesta este un parametru care arată conținutul cationilor de calciu și magneziu din apă.
Duritatea este proprietățile speciale ale apei, care determină în mare măsură calitățile sale de consum și, prin urmare, au o valoare economică importantă. Apa tare formează scară pe pereții cazanelor de încălzire, baterii etc., ceea ce le degradează semnificativ performanțele termice. Un astfel de strat subțire pe suprafața de încălzire nu este deloc inofensiv, deoarece durata încălzirii prin stratul de scrum, care are o conductivitate termică scăzută, crește treptat, partea de jos se arde mai repede și mai repede - la urma urmei, metalul se răcește mai încet și încet de fiecare dată, rămâne în stare încălzită mult timp. În final, se poate întâmpla ca fundul vasului să nu reziste și să permită scurgeri. Acest fapt este foarte periculos în industria în care există cazane de abur.
Apa tare nu este potrivită pentru spălare. Scara pe încălzitoarele mașinilor de spălat le scoate din ordine, înrăutățește și proprietățile de spălare ale săpunului. Cationii Ca 2+ și Mg 2+ reacționează cu acizii grași cu săpun pentru a forma săruri slab solubile, care creează filme și precipită, reducând în final calitatea spălării și crescând consumul de detergent, adică. apa tare strânge slab
Există două tipuri de rigiditate: temporară și permanentă. Această diferență se datorează tipului de anioni care sunt prezenți în soluție ca o contrabalansare a calciului și magneziului.
Duritate temporară asociate cu prezența în apă împreună cu cationii Ca 2+, Mg 2+ și Fe 2+ hidrocarbonat sau anioni bicarbonat (HCO 3 -).
Rigiditate permanentă (sau non-carbonat) apare dacă soluția este prezentă sulfat, clorură, azotat și alți anioni, ale căror săruri de calciu și magneziu sunt bine solubile și deci pur și simplu nu pot fi îndepărtate. Duritatea totală este definită ca conținutul total al tuturor sărurilor de calciu și magneziu din soluție.
Diferite țări au propriile lor standarde de duritate pentru apă. În țara noastră, apa este clasificată după duritate în acest fel:
Apa moale cu duritate mai mică de 3,0 mEq / l,
Duritate medie 3,0-6,0 mEq / L
Greu - mai mult de 6,0 mEq / ml.
Metode de eliminare a rigidității.
Pentru a scăpa de duritatea temporară trebuie doar să fierbeți apă. Când fierbe apa, anionii bicarbonatului reacționează cu cationii și formează cu ei săruri de carbonat foarte slab solubile, care precipită.
Ca2 + 2HCO 3 - \u003d CaCO3 ↓ + H2O + CO2
În cazul ionilor de fier, reacția este mai complicată datorită faptului că FeCO 3 este o substanță instabilă în apă. În prezența oxigenului, produsul final al lanțului de reacție este Fe (OH) 3, care este un precipitat roșu închis. Prin urmare, cu cât fierul este mai mare în apă, cu atât este mai puternică culoarea la scara, care este depusă pe pereții și pe fundul vasului în timpul fierberii.
Rigiditatea constantă este mai greu de combătut. O opțiune: înghețarea gheții. Trebuie doar să înghețați treptat apa. Când rămâne aproximativ 10% din lichidul din cantitatea inițială, este necesar să se scurgă apa neînghețată și să se transforme gheața înapoi în apă. Toate sărurile, care formează o duritate, rămân în apă nu înghețată.
Mâncarea este o cale - distilarea, adică evaporarea apei cu condensarea ulterioară. Deoarece sărurile sunt compuși non-volatili, acestea rămân și apa se evaporă.
Dar metodele precum congelarea și distilarea sunt potrivite numai pentru înmuierea unei cantități mici de apă. Industria se ocupă cu tone. Prin urmare, sunt utilizate alte metode. Cea mai utilizată metodă de schimb de cationi, bazată pe utilizarea de reactivi speciali - schimbătoare de cationi, care sunt încărcate în filtre și când trece apa prin ele, înlocuiesc cationii de calciu și magneziu cu cationi de sodiu.
Cu consecința durității scării apei, din punct de vedere al chimiei, poți lupta foarte ușor. Este necesar să influențați sarea unui acid slab cu un acid mai puternic. Acesta din urmă ia locul cărbunelui, care, fiind instabil, se descompune în apă și dioxid de carbon. Compoziția scării poate include silicați și sulfați și fosfați. Dar dacă distrugi „scheletul” carbonat, atunci acești compuși nu vor rămâne la suprafață.
Acidul adipic și anhidrida maleică, care sunt adăugate în apă, sunt de asemenea utilizate ca agenți de decalcare. Aceste substanțe sunt mai slabe decât acidul sulfamic, astfel încât fierberea este necesară și pentru decalare.
Referințe:
Shpausus Z. Călătorie în lumea chimiei - Moscova: Educație, 1967. - 431s.
Kharlampovici G.D. și altele .. Chimie pe mai multe fețe. - M .: Educație, 1992.-159 p.
Khomchenko G.P. Cartea de chimie –M .: New Wave, 1996. - 304p.
Eseuri similare:
Studiul proprietăților soluțiilor diluate ale polialaților, ținând cont de doi factori: conformația macromoleculelor în soluție și ordinea orientativă a moleculelor de solvent care le solvează, care a fost apreciată de parametrii termodinamici și structura soluției.
Scopul și structura filtrelor de ionit exacte paralel din prima și a doua etapă, cu acțiune mixtă. Caracterizarea tehnologiei de ionizare în contracurent. Descrierea metodei sodice-cationice de înmuiere a apei. Principiile desalinizării și desalinizării apei.
Schimbătorii de cationi și proprietățile lor. Procesul de înmuiere a apei prin cationizarea de sodiu. Balsam de apă hidrogen-sodiu-cationic. Metode de calc-cationită și cationizare parțială. Filtre de schimb de cationi și dispozitive auxiliare ale instalațiilor de schimb de cationi.
Ce este spuma și surfactanții. Tensiunea superficială ca fiind cea mai importantă caracteristică a interfeței de fază. Metode de studii experimentale privind influența durității apei asupra spumării și stabilității spumei pentru diferite tipuri de agenți tensioactivi.
Proprietățile apei și metodele de înmuiere a acesteia. Cerințe pentru duritatea apei consumate în industria de căldură și energie electrică. Bazele teoretice și metodele de determinare a durității apei folosind metoda complexometrică. Eșantionare, reactivi, determinare.
Producția de carbon prin descompunerea termică a lemnului, absorbția substanțelor dizolvate și a gazelor de cărbune. Interacțiunea dioxidului de carbon cu alcaliile, producerea de monoxid de carbon și studiul proprietăților sale. Familiarizarea cu proprietățile carbonatelor și bicarbonatelor.
Indicatori condiționali ai calității apei potabile. Determinarea substanțelor organice din apă, ioni de cupru și plumb. Metode de eliminare a durității apei. Modalități de curățare a apei. Prepararea unei soluții de lucru de sulfat de potasiu. Purificarea apei prin înghețare parțială.
Proprietățile chimice ale calciului. Utilizarea carbonatului de calciu pur în optică, calcarul în metalurgie - ca fluxuri. Gipsul ca hidrat cristalin de sulfat de calciu. Sarea de calciu a acidului fosforic ca principală componentă a fosforitelor și a apatitelor.
Varietatea compușilor de carbon, distribuția lor în natură și aplicare. Modificări alotrope. Proprietățile fizice și structura atomului de carbon liber. Proprietățile chimice ale carbonului. Carbonati si bicarbonati. Structura diamantului și a grafitului.
Caracterizarea litosferei, compoziția elementelor chimice și a mineralelor din scoarța terestră. Structura, compoziția chimică și funcțiile hidrosferei, atmosferei. Caracteristici ale fotosintezei substanțelor organice care apar în biosferă. Studiul proceselor biogeochimice.
Duritatea mare a apei în sistemele de încălzire și apă caldă menajeră afectează negativ procesele de transfer de căldură, crescând consumul de energie. În plus, apa de băut tare este dăunătoare sănătății umane. Pentru apă în diverse scopuri, se folosesc diferite metode de înmuiere.
Înmuierea apei este procesul de îndepărtare a sărurilor de duritate din apă. Dar ce este duritatea apei și de ce trebuie eliminată?
Conceptul de duritate a apei este de obicei asociat cu cationi de calciu (Ca 2+) și, într-o măsură mai mică, cu magneziu (Mg 2+). De fapt, toți cationii divalenți într-un grad sau altul afectează rigiditatea. Ei interacționează cu anioni, formând compuși (săruri de duritate) care pot precipita.
Sărurile de fier, mangan și stronțiu pot precipita și ele, dar, în practică, toate aceste elemente au un efect atât de mic asupra rigidității, încât sunt de obicei neglijate.
Aluminiul (Al 3+) și fierul feric (Fe 3+) afectează, de asemenea, duritatea, dar la nivelul de pH găsit în apele naturale, solubilitatea lor și, în consecință, „contribuția” la duritate sunt neglijabile. În mod similar, efectul nesemnificativ al bariului (Ba 2+) nu este luat în considerare.
Tipuri de rigiditate
Există mai multe tipuri de duritate a apei. Duritatea totală este determinată de concentrația totală a ionilor de calciu și magneziu. Este suma rigidității carbonatate (temporare) și a necarbonatelor (permanente).
Duritatea carbonatelor se datorează prezenței hidrocarbonatelor și carbonatelor în apă (la pH\u003e 8,3). Duritatea temporară este caracterizată de prezența în apă împreună cu cationii Ca 2+, Mg 2+ și Fe 2+ de hidrocarbonat sau anioni bicarbonat (HCO 3-). Acest tip de duritate este aproape complet eliminat prin fierberea apei și de aceea se numește duritate temporară. Când apa este încălzită, hidrocarburile se descompun pentru a forma acid carbonic și precipita carbonatul de calciu, hidroxidul de magneziu și fierul.
Duritatea non-carbonatată se datorează prezenței sărurilor de calciu și magneziu ale acizilor tari (sulfurice, nitrice, clorhidrice) și nu este eliminată prin fierbere, de aceea a primit numele de duritate constantă.
unități de măsură
În practica mondială, sunt utilizate mai multe unități de rigiditate, toate sunt corelate într-un anumit fel unele cu altele.
Unitatea de duritate este luată ca duritatea apei, în 1 l din care conțin 1 mmol de echivalenți de Ca 2+ sau Mg 2+. O unitate de duritate (1 mmol / L) corespunde conținutului de ioni de calciu egală cu 20,04 mg / L sau ioni de magneziu egală cu 12,15 mg / L. Duritatea totală a apei (H) poate fi calculată după formula:
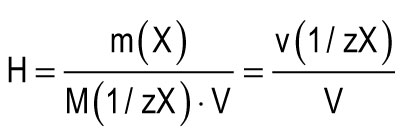
m (X) este masa substanței dizolvate, mg; M (1 / zX) este masa molară a echivalentului substanței, mg / mmol (g / mol); V este volumul de apă, l; M (1 / zCa 2+) \u003d 20,04 mg / mmol; M (1 / zMg 2+) \u003d 12,15 mg / mmol.
În plus, unitățile de rigiditate, cum ar fi gradul german (˚d, dH), gradul francez (˚f), gradul american și ppm CaCO 3 sunt utilizate pe scară largă în țările străine.
Raportul acestor unități de rigiditate este prezentat în tabel. 1.
Tabelul 1. Raportul dintre diferite unități de rigiditate
Deci, un grad german corespunde la 10 mg / dm 3 CaO sau 17,86 mg / dm 3 CaCO 3 în apă. Un grad francez este de 10 mg / dm 3 CaCO 3 în apă, iar gradul american este echivalent cu 1 mg / dm 3 CaCO 3 în apă.
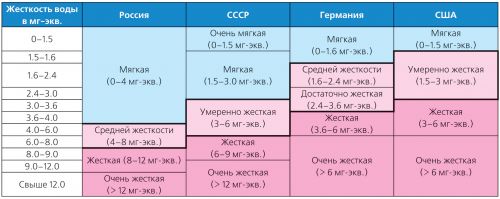
Duritatea apei variază mult și există multe tipuri de clasificări. Deci, în Germania, se aplică standardele de rigiditate ale Institutului German de Standardizare (DIN 19643), iar în SUA - clasificarea adoptată de Agenția pentru Protecția Mediului (USEPA) în 1986 (Tabelul 2).
Tabelul 2. Clasificarea diferitelor tipuri de rigiditate
Care apă este mai moale
În mod obișnuit, în apele mineralizate scăzute, duritatea predomină din cauza ionilor de calciu (deși în unele cazuri rare, duritatea magneziului poate atinge 50-60%). Odată cu creșterea gradului de mineralizare generală a apei, conținutul de ioni de calciu (Ca 2+) scade rapid și depășește rar 1 g / l. Conținutul de ioni de magneziu (Mg 2+) în apele puternic mineralizate poate ajunge la câteva grame, iar în lacurile sărate - zeci de grame pe litru de apă.
În general, duritatea apei de suprafață este în general mai mică decât duritatea apelor subterane. Duritatea apelor de suprafață este supusă unor fluctuații sezoniere vizibile, atingând de obicei cea mai mare valoare la sfârșitul iernii și cea mai mică în timpul inundațiilor, când este diluată din abundență cu ploaie moale și apă topită. Apa de mare și ocean are o duritate foarte mare (zeci și sute de meq / l).
Consecințele rigidității
Apa de băut tare este amară din cauza gustului de magneziu și are un efect negativ asupra sistemului digestiv. Conform standardelor Organizației Mondiale a Sănătății (OMS), duritatea optimă a apei potabile este de 1,0-2,0 mEq / l.
Produsele alimentare sunt slab digerate în apă tare, deoarece cationii de calciu cu proteinele alimentare formează compuși insolubili; valoarea lor nutritivă este redusă. Utilizarea constantă a apei dure poate duce la depunerea sărurilor (urolitiaza) în corpul uman.
Ceaiul și cafeaua sunt slab preparate în astfel de apă. În condiții casnice, un exces de săruri de duritate duce la scalarea suprafețelor de încălzire în cazane, ceainice, țevi, depunerea sărurilor pe instalațiile sanitare și defectarea acestora, lasă un depozit pe părul și pielea unei persoane, creând o senzație neplăcută de „duritatea” lor.
Duritatea apei utilizate la prepararea diverselor produse este clar reglată și se situează la nivelul de 0,1-0,2 mEq / l.
Apa tare formează scară pe pereții cazanelor de încălzire, baterii etc., care le afectează semnificativ performanțele termice, reduce secțiunea liberă a conductelor.
Conductele sunt depășite cu depozite la scară atât de mult încât productivitatea lor scade de mai multe ori. Prin urmare, în acele procese în care este permisă utilizarea apei cu un anumit conținut de sare, rigiditatea acesteia este limitată la valori chiar mai mici - 0,03-0,05 mEq / l.
Scara pe încălzitoarele de mașini de spălat le scoate din ordine. La spălare, interacționând cu substanțele active de suprafață (agenți tensioactivi) de săpun sau detergenți pentru rufe, sărurile de duritate le leagă și necesită mai mult consum. Apa tare nu poate fi utilizată atunci când se efectuează anumite procese tehnologice, de exemplu, în timpul vopsirii, în electrochimie ș.a.
Eliminarea sării
Procesele de extragere a sărurilor Ca 2+ și Mg 2+ din apă în tratarea apei se numesc înmuiere a apei.
Eliminarea relativ selectivă a sărurilor de duritate din apă poate fi realizată prin metode:
- tratament termic;
- distilare;
- înmuierea reactivilor;
- congelare;
- prelucrare magnetica;
- prelucrare cu ultrasunete;
- schimb de ioni;
- osmoză inversă.
Sunt cunoscute și metode de tratare a apei (efecte electromagnetice, adăugarea de polifosfați sau alte „anti-scară”), care permit „legarea” sărurilor de duritate pentru o perioadă, împiedicându-le să cadă sub formă de scară de ceva timp. Totuși, aceste metode nu neutralizează chimic sărurile de duritate, nu le îndepărtează și, prin urmare, au găsit o utilizare limitată în tratarea apei industriale.
Înmuiere termică
În acest fel, scapă de rigiditatea temporară cauzată de calciu și bicarbonatele de magneziu. Când fierbe apa, hidrocarburile se descompun pentru a forma un precipitat cu carbonat mediu sau de bază:
Ca (HCO3) 2 \u003d CaC03 ↓ + CO2 + H20,
Mg (HCO3) 2 \u003d Mg2 (OH) 2 CO 3 ↓ + 3CO 2 + H 2 O.
Drept urmare, duritatea apei este redusă. De aceea, rigiditatea bicarbonatului este numită temporară.
În cazul ionilor de fier, reacția este mai complicată datorită faptului că FeCO 3 este o substanță instabilă în apă. În prezența oxigenului, produsul final al lanțului de reacție este Fe (OH) 3, care este un precipitat roșu închis. Prin urmare, cu cât fierul este mai mare în apă, cu atât este mai puternică culoarea la scara, care este depusă pe pereții și pe fundul vasului în timpul fierberii.
Astfel, atunci când fierbe apa în viața de zi cu zi, procesul de înmuiere parțială are loc simultan.
distilare
Distilarea este o metodă tradițională, eficientă și fiabilă, care asigură un grad ridicat de purificare a apei cu un nivel ridicat de salinitate, cu salinitate și duritate ridicată.
Principiul general al obținerii apei prin această metodă este următorul: apa potabilă pre-preparată intră în distilator, care constă din trei componente principale: un evaporator, un condensator și un colector.
Evaporatorul cu apă se încălzește la fierbere. Vaporii de apă intră în condensator, unde sunt lichefiați și sub formă de distilat intră în colector. Toate impuritățile non-volatile prezente în apa sursă rămân în distilator.
Pentru obținerea apei purificate, se folosesc distilatoare, care diferă unele de altele în ceea ce privește modul de încălzire, productivitate și caracteristici de proiectare.
Metoda de distilare unică nu este economică, deoarece atunci când este utilizată, există costuri energetice mari pentru încălzire și evaporare (aproximativ 3000 kJ la 1 kg de abur), precum și consumul de apă pentru condensarea aburului (aproximativ 8 litri de apă și 1 kg de abur). Prin urmare, utilizarea unei singure distilări este recomandată pentru un consum redus de apă - 10-20 l / h.
Mai eficiente și mai economice decât distilarea convențională sunt distilatoarele cu mai multe coloane de înaltă performanță. Dar acestea sunt extrem de costisitoare, în plus, costurile de pretratare a apei pentru ele sunt mari.
De remarcat este faptul că metoda de distilare elimină toate sărurile dizolvate din apa sursă.
Aplicație de reactiv
Există o înmuiere a apei prin metoda liming, soding și sodă-sodiu de înmuiere a apei.
La liming, se adaugă calciu hidratat Ca (OH) 2 la soluție la un pH de aproximativ 10. Ca urmare, reacțiile au loc:
Ca (HCO3) 2 + Ca (OH) 2 \u003d 2 CaCO3 + 2H2 O,
Mg (HCO 3) 2 + 2Ca (OH) 2 \u003d Mg (OH) 2 + 2СaCO 3 + 2Н 2 O.
Această metodă se folosește pentru duritatea ridicată a carbonatului și a carbonului scăzut non-carbonat, atunci când este necesară o scădere simultană a durității și alcalinității. Rigiditatea reziduală este cu 0,4-0,8 mEq / L mai mare decât rigiditatea non-carbonatată.
Când s-a adăugat var de sodă, var calizat Ca (OH) 2 și sodă Na2 CO 3 se adaugă în apă la un pH de aproximativ 10. Ca urmare, apar următoarele reacții:
Ca (HCO3) 2 + Ca (OH) 2 + Na2 CO 3 \u003d 2 CaCO 3 + 2NaOH + H 2 CO 3,
Mg (HCO3) 2 + 2NaOH \u003d Mg (OH) 2 + 2NaHCO3.
După cum rezultă din ecuațiile de reacție, în procesul de formare și sedimentare a sedimentelor din apă, se extrag săruri de duritate. Împreună cu ele sunt îndepărtate particulele coloidale și suspendate cu poluarea asociată. Sedimentul organic este parțial sorbit pe fulgii sedimentului.
Odată cu excesul de sodiu, datorită excesului de ioni HCO3, se obține o mai mare completitate de îndepărtare a sărurilor de duritate din apă. Ridicarea temperaturii la 70-80 ° C vă permite să aduceți rigiditatea reziduală la 0,35-1,0 mEq / L. Același rezultat poate fi obținut prin creșterea dozelor de reactivi.
Metoda cu bicarbonat de sodă
Adăugarea de sodă este necesară dacă duritatea non-carbonatată este mai mare decât carbonatul. Dacă acești parametri sunt egali, este posibil ca adăugarea de sodă să nu fie deloc necesară.
Hidrocarbonatele de calciu și magneziu în reacție cu alcali formează compuși slab solubili de calciu și magneziu, sodă, apă și dioxid de carbon:
Ca (HCO3) 2 + 2NaOH \u003d CaCO3 ↓ + Na2 CO3 + 2H 2 O,
Mg (HCO3) 2 + 2NaOH \u003d Mg (OH) 2 ↓ + Na2C03 + H2O + CO2.
Dioxidul de carbon format ca urmare a reacției hidrogenatului carbonat de magneziu cu alcaliii reacționează din nou cu alcaliul pentru a forma sodă și apă:
CO2 + NaOH \u003d Na2C03 + H2O.
Duritate necarbonatată
Sulfatul și clorura de calciu reacționează cu soda formată în reacțiile durității carbonatului și a alcalinilor și adaugă sodă pentru a forma carbonat de calciu care nu se lipește de condițiile alcaline:
CaCl2 + Na2 CO 3 \u003d CaCO3 ↓ + 2NaCl,
CaSO4 + Na2 CO3 \u003d CaCO3 ↓ + Na2S04.
Sulfatul de magneziu și clorura reacționează cu alcaliul pentru a forma hidroxid de magneziu precipitat:
MgSO 4 + 2NaOH \u003d Mg (OH) 2 ↓ + Na2S04,
MgCl2 + 2NaOH \u003d Mg (OH) 2 ↓ + 2NaCl.
Datorită faptului că, în reacțiile bicarbonatului cu alcalin, se formează sodă, care reacționează ulterior cu duritatea non-carbonatică, cantitatea sa trebuie corelată în raport cu duritatea carbonatului (LFA) și a non-carbonatului (LFA):
- dacă sunt egale, soda poate fi omisă;
- în condiția Lc\u003e Lnc, se formează un exces de sodă;
- cu raportul LCD< Жнк - недостаток соды и ее необходимо добавлять.
Procesele de depunere se efectuează în rezervoare de sedimentare și clarificatoare cu un strat de sediment suspendat.
Rezervoarele de sedimentare sunt ineficiente, iar pulpa de hidroxid obținută în ele are o umiditate ridicată de 97-99%. Prin urmare, în prezent, practic nu sunt utilizate.
În practică, sunt utilizate diferite versiuni de clarificatoare cu un strat de sediment suspendat. În ele, soluția de purificat este furnizată de jos și trece prin stratul de sedimente. Aceasta crește coeficientul de purificare a apei.
Metodele de reactiv nu sunt utilizate la prepararea apei potabile. După ele, apa are o reacție puternic alcalină. Prin urmare, reactivii sunt utilizați pe scară largă în energie și industrie ca primă etapă de purificare a filtrelor mecanice. Atunci când lucrați împreună, vă permit să înmuiați apa, să eliminați solidele suspendate, inclusiv coloidele și să purificați parțial apa de substanțe organice.
congelare
Pentru a combate duritatea constantă a apei, se folosește o metodă precum înghețarea gheții. Pentru a face acest lucru, trebuie doar să înghețați treptat apa. Atunci când aproximativ 10% din lichid rămâne din cantitatea inițială, este necesar să se scurgă apa neaglată și să se transforme gheața înapoi în apă. Toate sărurile care formează duritate rămân în apă neînghețată.
Alături de distilare, este, în același timp, una dintre modalitățile de a desaliniza apa cu un nivel ridicat de soluție salată la o calitate potabilă.
Alte metode
Metoda de electrodializă se bazează pe fenomenul mișcării direcționate a ionilor de electroliți către electrozii conectați la o rețea de curent continuu. Astfel, ionii metalici, care determină duritatea apei, sunt prinși la electrozi și sunt separați de apă părăsind aparatul de tratare a apei.
Metoda de ionizare magnetică folosește și fenomenul mișcării direcționate a ionilor, dar deja sub influența unui câmp magnetic. Pentru a crește numărul de ioni în apă, este iradiat preliminar cu radiații ionizante.
Tratarea magnetică a apei constă în trecerea apei printr-un sistem de câmpuri magnetice cu direcții opuse. Drept urmare, există o scădere a gradului de hidratare a substanțelor dizolvate și a combinării acestora în particule mai mari care precipită.
Tratarea cu ultrasunete a apei duce, de asemenea, la formarea de particule mai mari de substanțe dizolvate cu formarea de sedimente.
Este recomandabil să luăm în considerare metoda de schimb ionic și procesele de osmoză inversă în a doua parte a articolului, pe care o vom publica în jurnalul nostru în numărul următor.
