Твърдостта на водата и нейното отстраняване. Задачи и упражнения за метали от iA подгрупата
Страница 1
Елиминирането на временната твърдост се извършва чрез вряла вода. След кипене хидрокарбонатите се разрушават и слабо разтворимите карбонати образуват утайка. Когато натриев карбонат, калциев хидроксид се въвежда във водата, общата твърдост на водата се отстранява. В този случай карбонатната твърдост се елиминира от вар, а некарбонатната твърдост се елиминира от сода.
Освен че елиминира временната твърдост, варът утаява целия магнезий и желязо от вода и насърчава коагулацията на органични и неорганични колоиди.
След почистване на примесите, елиминиране на временната твърдост и обезвъздушаване, допълващата вода се подава в топлообменника (2), където се нагрява до 335 К. След смесване, допълващата и връщащата се вода се изпомпва във втората зона на топлообменника (2), където се нагрява до 355 К и се влива в отоплителни мрежи.
Омекотяването често се използва за премахване на временната твърдост на водата, предназначена да компенсира загубите (презареждането) в затворени системи за водоснабдяване и за предотвратяване на минерални замърсявания на топлообменните и охлаждащи повърхности при контакт с циркулираща вода. В много случаи допълващата вода е основният източник на натрупване на калциеви йони и биокарбонати в циркулиращата вода, което в системи с високи коефициенти на изпаряване може да наруши стабилния състав на циркулиращата вода.
Омекотяването на водата с цел премахване на временната твърдост се осъществява химически чрез въвеждане на реагенти, които се използват като вар, сярна или солна киселина. Химическите методи постигат относително плитко омекване на водата. За по-висока степен на омекотяване се използват методи за катионен обмен, чиято същност е да се използва способността на определени вещества да обменят съдържащи се в тях катиони за катиони соли на твърдост във вода.
Сода каустик се използва в топлоелектрическите централи за премахване на временната твърдост на водата, за регенериране на ановитни филтри, използвани в инсталации за химическо обезсоляване на водата.
Сода каустик се използва в топлоелектрическите централи за премахване на временната твърдост на водата и за регенериране на анионни филтри, използвани в инсталации за химическо обезсоляване.
По подобен начин трябва да се изчисли и количеството Са (ОН) 2, необходимо за премахване на временната коравина.
Защо, за да се премахне временната скованост поради магнезиевите соли, е необходимо повече вар, отколкото да се премахне временната скованост поради калциевите соли.
Следователно, за презареждане на затворени (без очистване) системи за водоснабдяване, трябва да се извърши сравнително дълбоко омекотяване на пречистващата вода и премахване на временната твърдост.
Въвеждането на малки количества алкални реагенти повишава ефективността на магнитната обработка на водата, въпреки че въвеждането на алкални реагенти, например, вар в количества не повече от 10 - - 20% от тези, необходими за премахване на временната скованост, според проучвания, проведени в KhIEI през 1959 г., намалява образуването на мащаби 8 до 10 пъти.
В този случай се елиминира шест костната вода, причинена от бикарбонатите. Следователно тази скованост се нарича временна, или бикарбонатна. Следователно, за да се премахне временната скованост, е достатъчно да се вари вода.
Соли с постоянна твърдост, например, CaCl, CaSO4 и т.н., не се отстраняват от водата при нагряване. Те се утаяват по време на изпаряването на водата, образувайки се по стените на апарата, трудно отстраняващи се плътни мащаби. Твърдата вода може да се използва само в случаите, когато условията на нейната употреба не причиняват утаяване на твърди утайки, например в хладилници, където охлаждащата вода не се нагрява до температура, която помага да се премахне временната твърдост. В котелните инсталации, където водата не само се нагрява, но и се изпарява, не само временна, но и постоянна твърдост е неприемлива. Следователно водата за тях се пречиства предварително от калциеви и магнезиеви соли чрез химичен метод в специални растения.
Общинска образователна институция
„Средно училище №1
с задълбочено изучаване на отделни предмети
Адрес: област Белгород,
Тест за твърдост на водата
и начини за премахването му
ученик 11 "А" клас МО "Средно
средно училище №1
с задълбочено проучване
отделни елементи
Адрес: област Белгород,
Научен съветник :,
учител по химия
средно училище №1
с задълбочено проучване
отделни елементи
нов Оскол, област Белгород
Адрес: област Белгород,
нови Оскол,
нови Оскол
1. Въведение …………………………………………………………………………… .3
2. Твърдост на водата и методи за нейното отстраняване …………………………… .4
· Защо водата става твърда .............................................................. 4
· Стойността на твърдостта на водата в човешкия живот ...................................... 4
· Начини за премахване на сковаността ……………………………………… ... 5
3. Проучване на твърдостта на водата и методи за нейното отстраняване .............. ... 8
4. Заключение и изводи
5. Списък на референциите
въведение
Кой е изучавал науките, но не ги прилага,
подобно на този, който оре, но не сее.
Саади
През 80-те години на 20 век книгите на Пол Чапъс Брейг се появяват за популяризиране на здравословния начин на живот. И въпреки че много учени смятат мнението му за противоречиво, книгите на Пол Брейг заслужават внимание. Един от раздели на книгата му (Моите първи експерименти с твърдост) е посветен на проблема с твърдостта на водата, където авторът в спомените си описва болестта на дядо си, който умря от факта, че кръвоносните му съдове се вкамениха от твърда вода и на жената, която живееше в техните части ( нещастната жена била наречена каменна жена, тъй като тялото й било буквално вкаменено от голям брой соли). Тази жена беше една от многото жертви на твърда вода. Нещастните органи не успяха да се справят с преработката на голямо количество неорганични вещества, съдържащи се в такава вода, и те започнаха да се натрупват много активно в тялото й.
Калциевите съединения се утаяват в нашите тела под формата на камъни в бъбреците и жлъчния мехур.
Днес лечението с вода не е прищявка и разглезване, а по-скоро жизненоважна необходимост. Факт е, че такива неприятни явления като измет, миризми от трети страни, миризми, както и наличието на мътна утайка не само причиняват много неудобства, но и причиняват много заболявания. Нискокачествената вода насърчава отлагането на соли, ускорява процеса на стареене на организма и става причина за прехода на много заболявания към хроничен стадий. В допълнение, хлорът съдържа редица вещества, които могат да причинят рак. Но водата е в основата на целия живот и нито един жив организъм не може без вода. Например човек се състои от вода с 60-65%. Следователно чистата вода е жизненоважна за всеки човек. За съжаление, естествената вода в наше време е напълно неподходяща за консумация без предварителна обработка, което се потвърждава от различни анализи на водата. Всички знаят, че филтриращите станции, които уж извършват пречистване на водата, отдавна се нуждаят от основен ремонт и водоснабдителните системи, чрез които водата се доставя до домовете ни, изискват подмяна.
Целта на нашата работа беше да проучим нивото на твърдост на водата в родния ни град.
Твърдост на водата и методи за нейното отстраняване
Защо водата се втвърдява
Калцият и неговите съединения са много необходими за организма: в края на краищата, от калциев ортофосфат Ca3 (P04) 2 са съставени костите и зъбите на хората и животните. Те се формират от разтворими калциеви съединения, които пренасят кръв в цялото тяло. Благодарение на калциевите катиони Са2 +, кръвта е в състояние да се коагулира, образувайки съсиреци, запушвайки рани и спира кървенето.
Калциевите съединения са не само полезни, но и много вредни - например, когато придават твърдост на обикновената вода. В ежедневието думата „скованост“ на пръв поглед може да се приложи само за твърди частици: пейка в парка или столче в кухнята може да бъде твърдо. Водата обаче също е твърда.
Основният източник на магнезиеви и калциеви соли, които влизат във водата, са находищата на варовик, гипс и доломит, които са ерозирани от естествените води.
В нискосолени води повечето от калциевите йони. С увеличаване на степента на минерализация съдържанието на калциеви йони намалява бързо и рядко надвишава 1 g / l. Съдържанието на магнезиеви йони в минерализирани води може да достигне няколко грама, а в солените води няколко десетки грама.
Твърдост на водата - комбинация от химични и физични свойства на водата, свързани със съдържанието на разтворени соли на алкалоземни метали в нея, главно калций и магнезий. Водата с високо съдържание на такива соли се нарича твърда вода, с ниско съдържание - мека. Има временна скованост (карбонат), образувана от хидрокарбонати, и постоянна скованост (некарбонатна), причинена от присъствието на други соли. Временната скованост се дължи на присъствието на калциеви и магнезиеви бикарбонати (Ca (HCO3) 2; Mg (HCO3) 2) във вода. Постоянната твърдост на водата се дължи на наличието във водата на сулфати, Са и Mg хлориди (CaSO4, CaCl2, MgSO4, MgCl2).
Стойността на твърдостта на водата в живота на човека
Твърдостта на водата е сумата от калциевите йони Са2 + и магнезий Mg2 +, разтворени във вода.
Калциевите и магнезиеви йони не причиняват много вреди на живите организми, но присъствието им във вода в големи количества е нежелателно, тъй като такава вода е неподходяща за битови нужди.
В твърдата вода консумацията на сапун и прах се увеличава при миене на дрехи, месо и зеленчуци бавно се усвоява и се намалява подвижността на стомаха. Твърдата вода е неподходяща за водоснабдителни системи и оборудване за отопление на вода.
Твърдостта се измерва в милиграм еквивалент на литър (mEq / L). Индустриалните стандарти за допустими стойности на коравина зависят от вида на използваното оборудване. Обикновено се счита за твърда вода с твърдост от 1 mEq / L или повече.
Твърдостта е най-често срещаният проблем с качеството на водата. Първоначално терминът "твърда вода" се прилага за вода, която е трудно да се измие.
Твърдата вода, когато се измие, изсушава кожата, пяна се образува лошо в нея при използване на сапун. Употребата на твърда вода причинява появата на утайка (котлен камък) по стените на котлите, в тръбите и т.н. В същото време използването на твърде мека вода може да доведе до корозия на тръбите, тъй като в този случай няма киселинно-азотно буфериране, осигурено от хидрокарбонат (временна) скованост. Консумацията на твърда или мека вода обикновено не е опасна за здравето, въпреки че има доказателства, че високата твърдост допринася за образуването на камъни в урината, докато ниската твърдост леко повишава риска от сърдечно-съдови заболявания.
Твърдостта на естествените води може да варира доста широко и е нестабилна през цялата година. Твърдостта се увеличава поради изпаряването на водата, намалява през сезона на дъждовете, както и по време на топенето на снега и леда.
Начини за премахване на сковаността
разграничат цялостен скованост, която е съставена от временен и постоянен.
Кипене.
временен скованост (за еднократна употреба или карбонат) се дължи на присъствието на бикарбонати на Ca (HCO3) 2 и Mg (HCO3) 2 във вода. Въглеродната твърдост се отстранява лесно вряща водав който Са2 + и Mg2 + се отстраняват, за да образуват неразтворими утайки:
Ca (HCO3) 2 CaCO3 ↓ + CO2 + H2O
Mg йони се утаяват под формата на основен карбонат или под формата на магнезиев хидроксид (при рН\u003e 10.3).
2Mg2 + + OH) 2CO3 ↓ + CO2 + H2O
(OH-йони се образуват поради взаимодействието на йони с вода: и равновесието се измества надясно при нагряване).
За намаляване на карбонатната твърдост метод за варуване в която се въвежда пречистената вода варCa (OH) 2. Реакциите, възникващи при въвеждането на вар, могат да бъдат написани в молекулярна форма:
Ca (HCO3) 2 + Ca (OH) 2 → 2CaCO3 ↓ + H2O
Mg (НСО3) 2 + Са (ОН) 2 → Mg (ОН) 2 ↓ + 2СаСО3 + Н2О
Постоянната твърдост (невъзстановима или некарбонатна) се поддържа, когато водата се вари, тъй като постоянната твърдост се дължи на наличието във водата на сулфати, хлориди и други соли на Са и Mg. Количествено, тя е равна на концентрацията на йони Са2 + и Mg2 + минус твърдостта на времето. Обикновено се използва за намаляване на карбонатната твърдост. сода хлебна сода (Na2CO3):
MgSO4 + Na2CO3 → MgCO3 ↓ + Na2SO4
Докато добавяте ауспух и сода можете да се отървете от карбонатната и некарбонатната твърдост ( метод варово-содна).
Цялата твърдост се елиминира дори и при администрация натриев фосфат, натриев тетраборат и др. Тъй като ортофосфатите са по-малко разтворими от карбонатите, използването им във водата за омекотяване е по-удобно:
3CaSO4 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 3Na2SO4
Модерният начин за омекотяване на водата се основава на употреба йонообменни смоли - йонообменници (катиони и анионни обменници). Катионите са синтетични йонообменни смоли - алумосиликати, например:
Съставът им може условно да се изрази с общата формула Na2R, където Na + е силно подвижен катион, а R - е катионообменна частица, която носи отрицателен заряд.
Когато твърдата вода преминава през слой от катионообменна смола, катионите се обменят според реакциите:
Ca2 + + Na2R → 2Na + + CaR
Mg2 + + + Na2R → 2Na + + MgR
По този начин Са2 + и Mg2 + йони преминават от разтвора в катионообменна смола. За възстановяване на катионообменната смола се промива с концентриран разтвор на NaCl:
CaR + 2NaCl → CaCl2 + Na2R
След измиване катионообменната смола може да се използва отново за отстраняване на твърдостта от водата.
Обратна осмоза, Методът се основава на преминаването на водата през полупропускливи мембрани (обикновено полиамид). Заедно със солите за твърдост, повечето други соли също се отстраняват. Ефективността на почистването може да достигне 99,9%. Този метод намери най-голямо приложение в системите за пречистване на битова питейна вода. Като недостатък на този метод трябва да се отбележи необходимостта от предварителна подготовка на вода, подавана в мембраната с обратна осмоза.
Електродиализа. Той се основава на отстраняването на солите от водата чрез действието на електрическо поле. Отстраняването на йони от разтворени вещества става поради специални мембрани. Както при технологията за обратна осмоза, освен соли на твърдостта се отстраняват и други соли.
Термичен метод, Въз основа на нагряването на вода, елиминира само временната (карбонатна) коравина. Намира приложение в ежедневието. В промишлеността се използва например в ТЕЦ.
Омекотяване на реагентите Методът се основава на добавяне на сода или гасена вар към водата. В този случай калциевите и магнезиеви соли преминават в неразтворими съединения и в резултат се утаяват. Този метод е оправдан при относително висока консумация на вода, тъй като е свързан с решаването на редица специфични проблеми: филтрираща утайка, точна дозировка на реагента.
Катион обменна. Методът се основава на използването на йонообменно гранулирано зареждане (най-често йонообменни смоли). Такъв контакт при контакт с вода абсорбира катиони на соли на твърдост (калций и магнезий). В замяна, в зависимост от йонната форма, отделяйки натриеви или водородни йони. Тези методи се наричат \u200b\u200bсъответно Na-катион и Н-катион. По правило твърдостта на водата намалява с едноетапна катионизация на натрий до 0,05-0,1 mEq / L, с двустепенна - до 0,01 mEq / L.
Най-добър реагент За да се елиминира общата твърдост на водата, натриевият разтофосфат е Na3PO4: 3Ca (HCO3) 2 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 6NaHCO3 3MgSO4 + 2Na3PO4 → Mg3 (PO4) 2 ↓ + 3Na2SO4 Калциевите и магнезиеви ортофосфати са много солфосфати на калций и магнезий. по-добро омекотяване на водата. В промишлеността, използвайки йонообменни филтри, калциевите и магнезиеви йони се заменят с натриеви и калиеви йони, за да се получи мека вода. Известно омекване на водата се случва в битовите филтри за питейна вода. Филтрираната вода дава по-малко мащаб. Водата може да бъде напълно пречистена чрез дестилация (дестилация).
Днес има отлични водни филтри които се инсталират в апартамента без проблеми и служат като отлично средство за висококачествено пречистване на водата. Може би мнозина днес предпочитат да купуват бутилирана пречистена вода в супермаркетите. Изборът на такава вода е наистина огромен, но възможно ли е да сте 100% сигурни в качеството си? Може би не! Ето защо пречистването на водата с помощта на специално проектирани филтри за пречистване е най-оптималното решение за съвременен човек, който се грижи за здравето си и здравето на своите близки. Системите за пречистване на вода са много разнообразни. Като правило те се различават: производителност, някои параметри, степента на пречистване на водата, както и дизайн. Водните филтри перфектно почистват водата и я правят подходяща за пиене, намаляват съдържанието на алуминий, желязо, манган, хлор, всички видове нитрати в нея. В допълнение, филтрите за пречистване на водата помагат да се премахне неприятната миризма, вкус, както и да се отървете от микробите и бактериите, съдържащи се във водата. Пречистената чрез такива системи вода става по-малко твърда, но тя не губи полезни вещества, необходими за човешкото тяло. Водните филтри са отлична възможност да получавате пречистена вода в неограничени количества, без да напускате дома си. Правилно подбраният филтър ще бъде отлично решение на проблема с чистата вода, ще подобри здравето и ще удължи дълголетието ви.
Проучване на твърдостта на водата и методи за нейното отстраняване
Твърдостта на водата се дължи на наличието на Са2 + и Mg2 + йони. Колкото по-високо е тяхното съдържание в естествената вода (водата преминава през варовити скали и почви), толкова по-голяма е нейната твърдост.
Количествено, твърдостта на водата се изразява като сбор от милиеквиваленти на йони Са2 + и Mg2 +, съдържащи се в един литър вода (мекв / л). Един милиеквивалент на твърдост съответства на съдържание от 20,04 mg / L Ca2 + йони или 12,16 mg / L на Mg2 + йони.
Ето защо, когато решавате проблеми, можете да използвате формулата:
(ммол - еквив / л),
където m - масата на веществото, което прави твърдостта на водата или се използва за премахване на твърдостта на водата, mg;
Mae- еквивалентна маса на това вещество, g / mol;
V- обем на водата, l
По твърдост всички естествени води са разделени на мек(обща твърдост под 2 mmol / l) и труденсъс средна степен на твърдост (2-10 ммол / л) и висока степен на скованост (повече от 10 ммол / л).
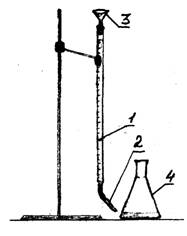
1 - бюретка
2 - капкомер
3 - фуния
Фигура 1 - Експериментална настройка
Изживяване с изпълнение
В три колби се измерва с голям градуиран цилиндър 100 ml вода. Добавете 2-3 капки метил оранжев индикатор към всяка колба с вода. Титруването се провежда 0,1 N. разтвор на солна киселина с помощта на бюрета. Задайте нивото на киселината в бюретата на нулево деление. Капнете солна киселина на капки, докато цветът на разтвора се промени от жълт до оранжево-розов. Запишете количеството киселина, което премина в титруване. Повторете титруването още два пъти. Въведете данните в таблицата.
Изчисляването се извършва по формулата:
![]() (ммол - еквив / л),
(ммол - еквив / л),
къде е нормалната концентрация на солна киселина;
Vcp ( HCl) - среден обем HCI, отишъл за титруване;
Vwater - обемът на водата, взета за титруване.
Получените данни сме проектирали под формата на таблица.
Водна проба
използва се за титруване
използва се за титруване на филтрирана вода
Кран за вода - химия
Вода от чешмата - ст. авиация
Вода от чешмата - ст. октомври
Вода от колоната - п. Крайбрежна
Вода от чешмата - ст. Покровски
Вода от кладенеца - ул. Покровски
Вода от чешмата - ст. Белгород
Вода от чешмата - ст. войник
Газирана вода "Красива"
В условията на училищната лаборатория проведохме изследване на водата, взета от различни източници за твърдост. За да се определи твърдостта, се използва титруване на естествена вода със солна киселина в присъствието на индикатор за метил оранжево. Карбонатната твърдост на водната проба се определя преди и след преминаването й през битов филтър (използва се аквафор).
В резултат на работата бяха направени следните изводи:
1) Водата в град Нови Оскол е твърда (W \u003d 7-10.5). Много хора живеят в частния сектор и използват вода от кладенци, а тази вода е много твърда.
2) Водата, постъпваща във водоснабдяването, се подлага на пречистване и омекване (L \u003d 6-7), следователно може да се счита за средна твърдост (съгласно GOST, общата твърдост на питейната вода не трябва да бъде повече от 7 mmol / l).
3) Най-лесният домашен начин за омекотяване на водата е традиционно кипене.
4) Експериментите показаха, че домакинските филтри също перфектно омекотяват водата. И така, водата, взета за изследване от кладенеца на ул. Покровски (твърдост 10,5 mmol / L), след филтриране, имаше твърдост само 2 mmol / L, което е дори по-ниско от физиологичната норма (3,5 mmol / L). По този начин водните филтри са отлична възможност да получавате пречистена вода в неограничени количества, без да напускате дома си.
Списък с референции
1.,. ръководство за практически хигиенни упражнения с техниката на санитарните изследвания. - М.: „Медицина”, 19-те.
2. и. Основите на химичния анализ. Учебно ръководство за студенти. - М .: „просветление“, 1971. - 192 с.
3. Неорганична химия: Учебник. за технолог спец. университетите. - М .: По-високо. училище., 1989 .-- 432 с.
4 ,. Ние наблюдаваме средата на нашия град: 9-11 клас: Училищна работилница. - М .: Човечество. изд. ВЛАДОС Център, 2001. - 112 с.
5. Химия: Реф. Ed. / Б. Schroeter, K.-H. Lautenschleger, H. Bibrak et al .: Per. с него._ М .: Химия, 1989. - Пер. изд .: ГДР, 1986.- 648 с.
Трансформационни вериги
1. Калциев карбонат Калциев оксид Калциев хидроксид Калциев карбонат Калциев нитрат.
2. Магнезиев сулфат магнезиев нитрат магнезиев оксид магнезиев ацетат.
3. Калциев хлорид Калциев сулфат Калциев сулфид Калциев сулфат Калциев хидроксид Калциев оксид Калциев хидрокарбонат.
4. Магнезий Магнезиев оксид Магнезиев хидроксид Магнезиев хлорид Магнезиев хидроксокарбонат Магнезиев сулфат Магнезиев хидроксид.
5. Магнезиев сулфид магнезиев оксид ... магнезиев хидроксид ... магнезиев нитрат.
6. Калций Калциев хидроксид Калциев карбонат Калциев оксид Калциев карбид Калциев хидроксид Калциев хидрокарбонат.
Задачи за уреждане
Ниво А
1. Взаимодействието на 13,7 g метал с вода отделя 2,24 литра газ (n.a.). Идентифицирайте метала. Каква утайка и в какво количество се образува, ако към получения разтвор се добави излишък от натриев сулфат?
решение
Газ (H 2) се отделя по време на взаимодействието на M Ia и IIa подгрупи с вода.
Според закона на еквивалентите:
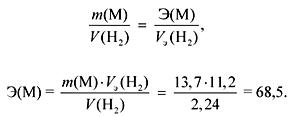
Ако M Ia подгрупи, тогава
А r (M) \u003d E валентност \u003d 68,5 (няма такъв метал).
Ако M IIa подгрупи, тогава
А r (M) \u003d E валентност \u003d 137 (Ba).
Ba + 2H20 \u003d Ba (OH) 2 + H2,
Ba (OH) 2 + Na2S04 \u003d BaSO4 + 2NaOH,
(BaSO 4) \u003d (Ba (OH) 2) \u003d (Ba) \u003d\u003d 0,1 мол,
m(BaSO 4) \u003d М\u003d 0,1 233 \u003d 23,3 g.
Отговорът, Метал - Ba; m(BaS04) \u003d 23,3 g.
2. Какъв обем от 0,5 М разтвор на калциев хидроксид трябва да се добави към 81 g 10% разтвор (плътност 1 g / cm 3) калциев бикарбонат, за да завърши образуването на утайка? Определете масата на утайката.
Отговорът, 100 ml Ca (OH) 2, 10 g CaCO3.
3. Разтворът, съдържащ 23,3 g смес от калиев сулфат и хромат, беше повлиян от излишък на бариев хлорид. Утайката се филтрира, промива се и след това към нея се добавя излишък от солна киселина. Част от утайката се разтваря, останалата част се филтрува, промива и суши. Масата на утайката след изсушаване е 23,3 g. Определете състава на първоначалната смес.
Отговорът, 17.4 g K2S04 и 5.9 g K2CrO4.
4. Има смес от калций, калциев оксид и калциев карбид с моларно съотношение на компонентите 1: 3: 4 (в реда на изброяване). Какъв обем вода може да влезе в химическо взаимодействие с 35 g такава смес?
Отговорът, 17.568 мл.
5. Разтворимостта на стронциев хидроксид във вода при 100 ° С е 28 g, а при 25 ° C - 1 g на 100 g вода. 200 g разтвор на стронциев хидроксид, наситен при 100 ° С, се охлажда до 25 ° С. Намерете масата на утаения октахидрат на стронциев хидроксид, когато разтворът се охлади.
Отговорът, 93.08 g Sr (OH) 2 8H20.
Ниво Б
1. Определена маса от кристален магнезиев карбонат се калцинира, докато се отдели газ. Последните се прекарват през промивни бутилки със концентрирана сярна киселина и варова вода. Масата на първата колба се увеличава с 1,8 g, а във втората 2 g утайка пада. Определете състава на изходния кристален хидрат и неговата маса.
Отговорът, MgCO 3 5H20 пентахидрат; 3,48 g
2. Моларното съотношение на карбонат, бикарбонат и калциев нитрат в смес с тегло 100 g е 1: 2: 3 (в реда на изброяване). Какъв обем при 1200 ° C и нормално налягане ще поемат газообразните продукти на разпадане на тази смес?
решение
Уравненията на реакциите на разлагане на компонентите на сместа:
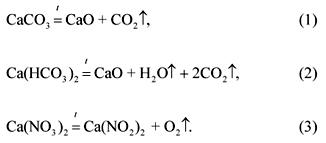
Със условието на проблема:
(СаСО 3): (Са (НСО 3) 2): (Са (NO 3) 2) \u003d 1: 2: 3.
Нека (CaCO 3) \u003d х къртицата.
Тогава (Ca (HCO 3) 2) \u003d 2 х;
(Са (NO 3) 2) \u003d 3 х;
100х + 162 2х +164 3х \u003d100,
х 0.109 мол.
при r \u003d 101,3 kPa и т \u003d 1200 ° C в газообразно състояние се освобождава:
CO 2 съгласно уравнение (1):
1 (CO 2) \u003d (CaCO 3) \u003d х \u003d 0.109 mol;
H 2 O, CO 2 съгласно уравнение (2):
2 (Н20) \u003d (Са (НСО 3) 2) \u003d 2 х \u003d 0,218 мола,
2 (CO 2) \u003d 2 (Са (HCO 3) 2) \u003d 4 х \u003d 0.436 mol;
O 2 съгласно уравнение (3):
3 (0) \u003d (Са (NO 3) 2) \u003d 3 х \u003d 0,327 мол.
Общият брой бенки на газообразни продукти на разпадане:
0,109 + 0,218 + 0,436 + 0,327 \u003d 1,09 mol (n.a.).
От уравнението на състоянието на идеалните газове намираме обема:
pV = RT,
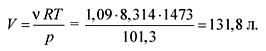
Отговорът. V \u003d 131,8 литра
3. Смес от равни количества двувалентен метален хидроксид и карбонат се калцинира. Масата на твърдия остатък се оказва 1.775 пъти по-малка от масата на първоначалната смес. Към този остатък се добавя 10 пъти голяма маса от 5% разтвор на сярна киселина. Изчислява се масовата част на веществата в получения разтвор.
Отговорът, 6% MgS04.
4. Когато водата, обработена със смес от хидрид и нитрид на двувалентния метал с равни масови фракции, се образува газова смес с плътност на водорода от 2.658. Задайте метала, включен в съединенията (не закръгляйте числата, когато изчислявате!).
Отговорът, Калций.
5. 16 g магнезиева плоча беше пусната в 16% разтвор на меден (II) сулфат с тегло 350 g. Когато плочата беше отстранена, масовите фракции на солите, съдържащи се в разтвора, се оказаха същите. Колко пъти увеличава масата на чинията?
Отговорът. 4,5 пъти.
Задачи за качество
1. Кое от тези вещества ще взаимодейства с магнезиев хидроксид: солна киселина, азотна киселина, въглероден диоксид, натриев хлорид, бариев хидроксид, сярна киселина, меден (II) оксид?
Отговорът, HCl, HNO3, H2S04.
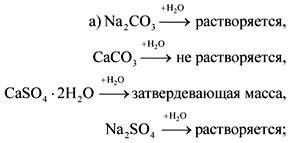
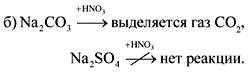
2. В бутилки без етикети са сода, креда, гипс и натриев сулфат. Как тези вещества могат да бъдат разпознати с вода и азотна киселина?
Отговорът.
3. Веществото А е лек, доста твърд сребристо-бял метал. При взаимодействието на вещество А с В, което е обикновено газообразно вещество, се образува съединение С, което е разтворимо във вода и образува алкален разтвор. При обработка на веществото Със сярна киселина се образува сол, чийто кристален хидрат се използва в медицината за прилагане на фиксиращи превръзки за фрактури. Дайте уравненията на реакцията.
Отговорът, А е Са; В е Н2; С е CaH2; кристален хидрат - CaSO 4 2H 2 O.
4. Вещество А е разтворим във вода оксид за образуване на алкален разтвор. Съединение В в този разтвор реагира с газ без мирис и образува бяла утайка, която постепенно се разтваря с преминаване на газ С. Дайте реакционните уравнения и идентифицирайте веществата.
Отговорът, A е CaO, BaO; B е Ca (OH) 2, Ba (OH) 2; С е CO 2.
5. Вещество А, което е част от един от най-разпространените минерали в земната кора, се разлага при висока температура в два оксида, единият от които В винаги се образува в процеса на живот. Когато веществото В взаимодейства с графита, при нагряване газът С, който е токсичен за топлокръвните животни, е запалим, безцветен и без мирис. Дайте уравненията на реакциите, идентифицирайте вещества.
Отговорът, A - CaCO 3; B е CO 2; С - СО.
Твърдостта на водата и нейното отстраняване
Резюме на химията
тема:„Твърдост на водата“
Изпълнител на работа:Грабин Павел.
план
Въведение 3
Определяне на твърдостта на водата. 3
Техники за укрепване 4
Референции 6
въведение
В пещерите пещерняците се срещат с най-красивите варовикови образувания - сталактити, висящи от арките и сталагмити, растящи нагоре. От гледна точка на химията появата на тези невероятни творения на природата е твърдостта на подземните води. Ние срещаме концепцията за твърдост на водата не само в спелеологията и геологията, но и като цяло навсякъде - в химията, технологиите и дори в ежедневието. Ето защо тази концепция е много важна за определяне качеството на водата.
Определяне на твърдостта на водата
Твърдост на водата - свойството на водата (да не се мие, да се дава мащаб в парни котли), свързано със съдържанието на разтворими в нея калциеви и магнезиеви съединения, това е параметър, показващ съдържанието на калциеви и магнезиеви катиони във вода.
Твърдостта е специалните свойства на водата, които до голяма степен определят нейните потребителски качества и поради това имат важна икономическа стойност. Твърдата вода образува мащаб по стените на отоплителните котли, батерии и др., Което значително влошава топлинните им характеристики. Такъв тънък слой върху нагревателната повърхност изобщо не е безобиден, тъй като продължителността на нагряване през слоевия слой, който има ниска топлопроводимост, постепенно се увеличава, дъното изгаря все по-бързо и по-бързо - в края на краищата металът се охлажда по-бавно и бавно всеки път, той остава в нагрято състояние за дълго време. В крайна сметка може да се случи дъното на съда да не издържи и да позволи изтичане. Този факт е много опасен в промишлеността, където съществуват парни котли.
Твърдата вода не е подходяща за измиване. Скалата върху нагревателите на пералните машини ги изважда от строя, влошава и миещите свойства на сапуна. Катионите Са 2+ и Mg 2+ реагират със сапунени мастни киселини, за да образуват слабо разтворими соли, които създават филми и утайки, в крайна сметка намалявайки качеството на измиване и увеличавайки консумацията на детергент, т.е. твърдата вода мие слабо
Има два вида скованост: временна и постоянна. Тази разлика се дължи на типа аниони, които присъстват в разтвора като противовес на калция и магнезия.
Временна твърдост свързани с присъствието във вода, заедно с катиони Ca 2+, Mg 2+ и Fe 2+ на хидрокарбонатни или бикарбонатни аниони (HCO 3 -).
Постоянна скованост (или некарбонатна) възниква, ако в разтвора присъстват сулфат, хлорид, нитрати и други аниони, чиито калциеви и магнезиеви соли са добре разтворими и затова просто не могат да бъдат отстранени. Общата твърдост се определя като общото съдържание на всички калциеви и магнезиеви соли в разтвора.
Различните страни имат свои собствени стандарти за твърдост на водата. У нас водата се класифицира по твърдост по този начин:
Мека вода с твърдост под 3,0 mEq / l,
Средна твърдост 3.0-6.0 mEq / L
Твърд - повече от 6,0 mEq / ml.
Методи за премахване на сковаността.
За да се отървете от временната твърдост, просто трябва да кипнете вода. При кипене на вода бикарбонатните аниони реагират с катиони и образуват с тях много слабо разтворими карбонатни соли, които се утаяват.
Ca 2 + 2HCO 3 - \u003d CaCO 3 ↓ + H 2 O + CO 2
С железните йони реакцията е по-сложна поради факта, че FeCO 3 е нестабилно вещество във вода. В присъствието на кислород, крайният продукт на реакционната верига е Fe (OH) 3, което е тъмночервена утайка. Следователно, колкото повече желязо във водата, толкова по-силен е цветът в мащаба, който се отлага по стените и дъното на съда по време на кипене.
Постоянната скованост е по-трудна за борба. Един вариант: замразяване на лед. Просто трябва постепенно да замръзвате водата. Когато остане приблизително 10% от течността от първоначалното количество, е необходимо да се източи незамразената вода и ледът да се превърне обратно във вода. Всички соли, които образуват твърдост, остават в незамразена вода.
Храната е един от начините - дестилация, тоест изпаряване на водата с последващата й кондензация. Тъй като солите са нелетливи съединения, те остават и водата се изпарява.
Но методи като замразяване и дестилация са подходящи само за омекотяване на малко количество вода. Промишлеността се занимава с тонове. Затова се използват и други методи. Най-широко използваният метод за катионен обмен, основан на използването на специални реагенти - катионни обменници, които се зареждат във филтрите и когато вода преминава през тях, заместват калциевите и магнезиевите катиони с натриев катион.
С последицата на твърдостта на водния мащаб от гледна точка на химията можете да се борите много лесно. Необходимо е да се повлияе на солта на слабата киселина с по-силна киселина. Последният заема мястото на въглищата, които, като са нестабилни, се разлагат на вода и въглероден диоксид. Съставът на мащаба може да включва силикати, и сулфати, и фосфати. Но ако унищожите карбонатния "скелет", тогава тези съединения няма да останат на повърхността.
Адипиновата киселина и малеиновият анхидрид, които се добавят към водата, също се използват като отстраняване на камъни. Тези вещества са по-слаби от сулфамовата киселина, така че варенето е необходимо и за отстраняване на накис.
Литература:
Шпаус З. Пътуване в света на химията - Москва: Образование, 1967. - 431с.
Харлампович Г.Д. и др. Многостранна химия. - М .: Образование, 1992.-159 с.
Хомченко Г.П. Учебник по химия –М .: Нова вълна, 1996. - 304 с.
Подобни есета:
Изследването на свойствата на разредени разтвори на полиарилати, като се вземат предвид два фактора: конформацията на макромолекулите в разтвора и ориентационния ред на разтварящите ги молекули на разтворителя, което се преценява по термодинамичните параметри и структурата на разтвора.
Предназначение и структура на паралелно точни йонитни филтри от първия и втория етап, смесено действие. Характеристика на технологията за йонизация в противоток. Описание на натриево-катионния метод за омекотяване с вода. Принципите на обезсоляване и обезсоляване на водата.
Катиони и техните свойства. Процесът на омекване на водата чрез катионизация на натрий. Омекотител за обмен на водород-натрий-катион. Методи на калциция-катионит и частична катионизация. Катионни филтри и спомагателни устройства на катионообменните инсталации.
Какво представлява пяната и повърхностноактивните вещества. Повърхностното напрежение като най-важната характеристика на фазовия интерфейс. Методи за експериментални изследвания на влиянието на твърдостта на водата върху пенообразуването и стабилността на пяната за различни видове ПАВ.
Свойства на водата и методи за омекотяването й. Изисквания за твърдостта на консумираната вода в топлоенергийната промишленост. Теоретични основи и методи за определяне на твърдостта на водата с помощта на комплексометричния метод. Вземане на проби, реактиви, определяне.
Производството на въглерод чрез термично разлагане на дървесината, усвояването на разтворени вещества и газове от въглища. Взаимодействието на въглеродния диоксид с алкала, производството на въглероден оксид и изследването на неговите свойства. Запознаване със свойствата на карбонатите и бикарбонатите.
Условни показатели за качеството на питейната вода. Определяне на органични вещества във вода, мед и оловни йони. Методи за премахване на твърдостта на водата. Начини за почистване на водата. Приготвяне на работен разтвор на калиев сулфат. Пречистване на водата чрез частично замразяване.
Химични свойства на калция. Използването на чист калциев карбонат в оптиката, варовик в металургията - като флюси. Гипс като кристален хидрат на калциев сулфат. Калциева сол на фосфорната киселина като основен компонент на фосфоритите и апатитите.
Разнообразието от въглеродни съединения, тяхното разпространение в природата и приложението. Алотропни модификации. Физични свойства и структура на свободния въглероден атом. Химични свойства на въглерода. Карбонати и бикарбонати. Структурата на диаманта и графита.
Характеристика на литосферата, състава на химичните елементи и минералите в земната кора. Структурата, химичният състав и функциите на хидросферата, атмосферата. Характеристики на фотосинтезата на органични вещества, протичащи в биосферата. Изследването на биогеохимичните процеси.
Високата твърдост на водата в отоплителните и битови системи за гореща вода се отразява негативно на процесите на пренос на топлина, увеличавайки консумацията на енергия. Освен това твърдата питейна вода е вредна за човешкото здраве. За вода за различни цели се използват различни методи за омекотяване.
Омекотяването на водата е процесът на отстраняване на солите от твърдост от водата. Но какво е твърдост на водата и защо трябва да се отстранява?
Понятието за твърдост на водата обикновено се свързва с катиони на калций (Са 2+) и в по-малка степен на магнезий (Mg 2+). Всъщност всички двувалентни катиони в една или друга степен влияят на сковаността. Те взаимодействат с аниони, образувайки съединения (соли на твърдост), които могат да се утаяват.
Соли на желязо, манган и стронций също могат да се утаяват, но на практика всички тези елементи имат толкова малък ефект върху сковаността, че обикновено се пренебрегват.
Алуминият (Al 3+) и железното желязо (Fe 3+) също влияят върху твърдостта, но при нивата на рН, намиращи се в естествените води, тяхната разтворимост и съответно „приносът“ към твърдостта са незначителни. По подобен начин незначителният ефект на бария (Ba 2+) не се взема предвид.
Видове скованост
Има няколко вида твърдост на водата. Общата твърдост се определя от общата концентрация на калциеви и магнезиеви йони. Тя е сумата от карбонатна (временна) и некарбонатна (постоянна) коравина.
Твърдостта на карбонатите се дължи на присъствието на хидрокарбонати и карбонати във вода (при рН\u003e 8,3). Временната твърдост се характеризира с присъствието във водата, заедно с катиони Са 2+, Mg 2+ и Fe 2+ на хидрокарбонат или бикарбонатни аниони (HCO 3-). Този вид твърдост почти напълно се елиминира чрез вряла вода и затова се нарича временна твърдост. Когато водата се нагрява, хидрокарбонатите се разлагат, образувайки въглеродна киселина и утаяват калциев карбонат, магнезиев хидроксид и желязо.
Некарбонатната твърдост се дължи на наличието на калциеви и магнезиеви соли на силни киселини (сярна, азотна, солна) и не се елиминира чрез кипене, поради което е получила името на постоянна твърдост.
мерни единици
В световната практика се използват няколко единици коравина, всички те са свързани по определен начин помежду си.
Единицата за твърдост се приема за твърдост на водата, в 1 1 от която се съдържа 1 mmol еквиваленти на Ca 2+ или Mg 2+. Една единица твърдост (1 mmol / L) съответства на съдържанието на калциеви йони, равно на 20.04 mg / L или на магнезиеви йони, равно на 12.15 mg / L. Общата твърдост на водата (H) може да се изчисли по формулата:
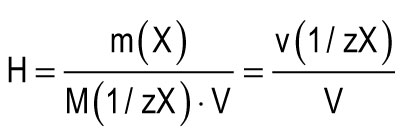
m (X) е масата на разтвореното вещество, mg; М (1 / zX) е моларната маса на еквивалента на веществото, mg / mmol (g / mol); V е обемът на водата, l; М (1 / zCa2+) \u003d 20,04 mg / mmol; М (1 / zMg 2+) \u003d 12,15 mg / mmol.
В допълнение, единиците за твърдост като немската степен (˚d, dH), френската степен (˚f), американската степен и ppm CaCO 3 са широко използвани в чужди страни.
Съотношението на тези единици за твърдост е представено в табл. 1.
Таблица 1. Съотношението на различните единици на твърдост
И така, една немска степен съответства на 10 mg / dm 3 CaO или 17,86 mg / dm 3 CaCO 3 във вода. Една френска степен е 10 mg / dm 3 CaCO 3 във вода, а американската степен е еквивалентна на 1 mg / dm 3 CaCO 3 във вода.
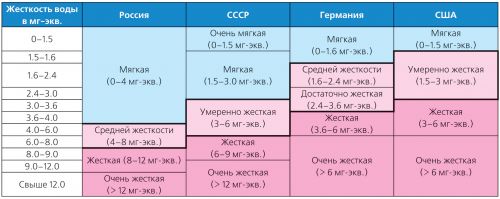
Твърдостта на водата варира в широки граници и има много видове класификации. Така че в Германия се прилагат стандартите за твърдост на Германския институт за стандартизация (DIN 19643), а в САЩ - класификацията, приета от Агенцията за опазване на околната среда (USEPA) през 1986 г. (Таблица 2).
Таблица 2. Класификация на различни видове коравина
Коя вода е по-мека
Обикновено в слабоминерализирани води преобладава твърдостта поради калциеви йони (въпреки че в някои редки случаи магнезиевата твърдост може да достигне 50-60%). С увеличаване на степента на обща минерализация на водата съдържанието на калциеви йони (Са 2+) бързо намалява и рядко надвишава 1 g / l. Съдържанието на магнезиеви йони (Mg 2+) в силно солени води може да достигне няколко грама, а в солените езера - десетки грама на литър вода.
По принцип твърдостта на повърхностните води обикновено е по-малка от твърдостта на подземните води. Твърдостта на повърхностните води е обект на забележими сезонни колебания, обикновено достигащи най-голямата си стойност в края на зимата и най-ниската по време на наводнение, когато е обилно разредена с мек дъжд и стопила вода. Морската и океанската вода имат много висока твърдост (десетки и стотици мекв / л).
Последствия от скованост
Твърдата питейна вода е горчива заради вкуса на магнезий и има отрицателен ефект върху храносмилателната система. Според стандартите на Световната здравна организация (СЗО) оптималната твърдост на питейната вода е 1,0-2,0 mEq / l.
Хранителните продукти се усвояват слабо в твърда вода, тъй като калциевите катиони с хранителните протеини образуват неразтворими съединения; хранителната им стойност е намалена. Постоянната употреба на твърда вода може да доведе до отлагането на соли (уролитиаза) в човешкото тяло.
Чаят и кафето се варят лошо в такава вода. В домашни условия излишъкът от соли за твърдост води до мащабиране на нагревателните повърхности в котлите, чайниците, тръбите, отлагането на соли върху водопроводните тела и отказът им, оставят отлагания върху косата и кожата на човек, създавайки неприятно усещане за тяхната „твърдост“.
Твърдостта на водата, използвана за приготвяне на различни продукти, е ясно регулирана и е на нивото от 0,1-0,2 mEq / l.
Твърдата вода образува котлен камък по стените на котлите за отопление, батерии и др., Което значително влошава топлинните им характеристики, намалява свободното сечение на тръбопроводите.
Тръбопроводите са обрасли с мащабни отлагания толкова много, че тяхната производителност спада няколко пъти. Следователно, при тези процеси, при които използването на вода с определено съдържание на сол е допустимо, нейната твърдост е ограничена до още по-ниски стойности - 0,03-0,05 mEq / l.
Скалата на нагревателите на пералните машини ги извежда от строя. При миене, взаимодействие с повърхностно активни вещества (повърхностно активни вещества) от сапун или перилни препарати, солите за твърдост ги свързват и изискват повече консумация. Твърдата вода не може да се използва при извършване на определени технологични процеси, например по време на боядисване, в електрохимията и т.н.
Премахване на сол
Процесите на извличане на соли на Са 2+ и Mg 2+ от вода във водна обработка се наричат \u200b\u200bомекотяване на водата.
Относително селективно отстраняване на солите на твърдостта от водата може да се извърши по методи:
- термична обработка;
- дестилация;
- омекотяване на реагенти;
- замразяване;
- магнитна обработка;
- ултразвукова обработка;
- йонен обмен;
- обратна осмоза.
Известни са и методите за обработка на водата (електромагнитни ефекти, добавяне на полифосфати или други "анти-мащаби"), които позволяват да се "свързват" солите на твърдостта за известно време, предотвратявайки изпадането им под формата на мащаб за известно време. Тези методи обаче не неутрализират химически солите на твърдостта, всъщност не ги отстраняват и следователно са намерили ограничена употреба при обработката на промишлени води.
Термично омекотяване
По този начин те се отърват от временната скованост, причинена от бикарбонатите на калций и магнезий. Когато кипне вода, въглеводородите се разлагат, за да образуват утайка от средна или основна карбонатна:
Ca (HCO 3) 2 \u003d CaCO 3 ↓ + CO 2 + H 2 O,
Mg (HCO 3) 2 \u003d Mg2 (OH) 2 CO 3 ↓ + 3CO 2 + H20.
В резултат на това твърдостта на водата се намалява. Ето защо сковаността на бикарбоната се нарича временна.
С железните йони реакцията е по-сложна поради факта, че FeCO 3 е нестабилно вещество във вода. В присъствието на кислород, крайният продукт на реакционната верига е Fe (OH) 3, което е тъмночервена утайка. Следователно, колкото повече желязо във водата, толкова по-силен е цветът в мащаба, който се отлага по стените и дъното на съда по време на кипене.
Така при кипене на вода във всекидневния живот протича едновременно процесът на нейното частично омекване.
дестилация
Дестилацията е традиционен, ефективен и надежден метод, който осигурява висока степен на пречистване на силно солена вода с висока соленост и твърдост.
Общият принцип за получаване на вода по този метод е следният: предварително приготвената питейна вода влиза в дестилатора, който се състои от три основни компонента: изпарител, кондензатор и колектор.
Изпарителят с вода се нагрява до кипене. Водната пара влиза в кондензатора, където те се втечняват и под формата на дестилат влизат в колектора. Всички енергонезависими примеси, присъстващи в изходната вода, остават в дестилатора.
За получаване на пречистена вода се използват дестилатори, които се различават един от друг по начина на нагряване, производителност и характеристики на дизайна.
Методът на единична дестилация е неикономичен, тъй като когато се използва, има големи енергийни разходи за отопление и изпаряване (около 3000 kJ на 1 кг пара), както и консумацията на вода за кондензация на пара (около 8 литра вода 1 кг пара). Затова използването на единична дестилация е препоръчително при ниска консумация на вода - 10-20 l / h.
По-ефективни и икономични от конвенционалната дестилация са високоефективните многоколонови дестилатори. Но те са изключително скъпи, в допълнение, разходите за предварителна обработка на водата за тях са високи.
Струва си да се отбележи, че методът на дестилация премахва всички разтворени соли в изходната вода.
Приложение на реагента
Има омекотяване на водата чрез варуване, сода-варовик и содо-натриев метод за омекотяване на водата.
При варуване към разтвора се добавя хидратирана вар Ca (OH) 2 до рН около 10. В резултат реакциите продължават:
Са (HCO 3) 2 + Са (OH) 2 \u003d 2 СаСО 3 + 2Н 2 О,
Mg (HCO 3) 2 + 2Ca (OH) 2 \u003d Mg (OH) 2 + 2СаСО 3 + 2Н 2 О.
Този метод се използва при висока карбонатна и ниска некарбонатна твърдост на водата, когато се изисква едновременно намаляване на твърдостта и алкалността. Остатъчната коравина е с 0,4-0,8 mEq / L по-висока от некарбонатната коравина.
Когато се добави газирана вар, гасена вар Ca (OH) 2 и сода Na 2 CO 3 се добавят към вода до рН около 10. В резултат на това възникват следните реакции:
Ca (HCO 3) 2 + Ca (OH) 2 + Na 2 CO 3 \u003d 2 CaCO 3 + 2NaOH + H 2 CO 3,
Mg (HCO 3) 2 + 2NaOH \u003d Mg (OH) 2 + 2NaHCO3.
Както следва от реакционните уравнения, в процеса на образуване и утаяване на утайката от вода се извличат соли на твърдост. Заедно с тях се отстраняват колоидни и суспендирани частици със свързано замърсяване. Органичната утайка е частично сорбирана върху люспите на утайката.
С газирането на сода, поради излишъка на йони на HCO 3, се постига по-голяма пълнота на отстраняване на солите на твърдостта от водата. Повишаването на температурата до 70-80 ° C ви позволява да доведете остатъчната твърдост до 0,35-1,0 mEq / L. Същият резултат може да бъде постигнат чрез увеличаване на дозите реагенти.
Метод на сода сода
Добавянето на сода е необходимо, ако некарбонатната твърдост е по-голяма от карбонатната. Ако тези параметри са равни, добавянето на сода може да не е необходимо изобщо.
Хидрокарбонатите на калций и магнезий в реакция с алкали образуват слабо разтворими съединения на калций и магнезий, сода, вода и въглероден диоксид:
Ca (HCO 3) 2 + 2NaOH \u003d CaCO 3 ↓ + Na 2 CO 3 + 2H 2 O,
Mg (HCO 3) 2 + 2NaOH \u003d Mg (OH) 2 ↓ + Na2C03 + H2O + CO 2.
Въглеродният диоксид, образуван в резултат на реакцията на магнезиев хидрогенкарбонат с алкал, реагира отново с алкал и образува сода и вода:
CO 2 + NaOH \u003d Na 2 CO 3 + H 2 O.
Некарбонатна твърдост
Сулфат и калциев хлорид реагират със сода, образувана в реакциите на карбонатна твърдост и алкали, и добавя сода за образуване на калциев карбонат, който не се придържа към алкални условия:
CaCl 2 + Na 2 CO 3 \u003d CaCO 3 ↓ + 2NaCl,
CaSO 4 + Na 2 CO 3 \u003d CaCO 3 ↓ + Na 2 SO 4.
Магнезиевият сулфат и хлорид взаимодействат с алкала и образуват утаен магнезиев хидроксид:
MgSO 4 + 2NaOH \u003d Mg (OH) 2 ↓ + Na2S04,
MgCl 2 + 2NaOH \u003d Mg (OH) 2 ↓ + 2NaCl.
Поради факта, че при реакциите на бикарбонат с алкал се образува сода, която впоследствие реагира с некарбонатна твърдост, нейното количество трябва да бъде съпоставено в съотношението на карбонатна (LFA) и некарбонатна (LFA) твърдост:
- ако са равни, содата може да се пропусне;
- при условие на Zhk\u003e Zhnk се образува излишък от сода;
- със съотношението на LCD< Жнк - недостаток соды и ее необходимо добавлять.
Процесите на отлагане се извършват в седиментационни резервоари и пречистватели с суспендиран слой на утайката.
Резервоарите за утаяване са неефективни, а получената в тях хидроксидна пулпа има висока влажност от 97-99%. Затова в момента те практически не се използват.
На практика се използват различни версии на пречистватели с суспендиран слой на утайката. В тях разтворът, който се пречиства, се подава отдолу и преминава през утайковия слой. Това увеличава коефициента на пречистване на водата.
Реактивните методи не се използват при приготвянето на питейна вода. След тях водата има силно алкална реакция. Следователно, реагентите са широко използвани в енергетиката и промишлеността като първи етап на пречистване до механични филтри. Когато работите заедно, те ви позволяват да омекотите водата, да премахнете суспендираните твърди частици, включително колоидите, и частично да пречистите водата от органични вещества.
замръзване
За борба с постоянната твърдост на водата се използва метод като замразяване на лед. За да направите това, просто трябва постепенно да замразите водата. Когато приблизително 10% от течността остане от първоначалното количество, е необходимо да се източи незамразената вода и ледът да се превърне обратно във вода. Всички соли, които образуват твърдост, остават в замръзнала вода.
Наред с дестилацията, той е едновременно и един от начините за обезсоляване на силно солена вода до питейно качество.
Други методи
Методът на електродиализа се основава на явлението насочено движение на електролитните йони към електродите, свързани към мрежа с постоянен ток. По този начин металните йони, които определят твърдостта на водата, се улавят при електродите и се отделят от водата, напускаща апарата за обработка на водата.
Методът на магнитна йонизация също използва явлението насочено движение на йони, но вече под въздействието на магнитно поле. За да се увеличи броят на йони във вода, тя предварително се облъчва с йонизираща радиация.
Магнитната обработка на водата се състои в преминаване на водата през система от магнитни полета в противоположни посоки. В резултат на това се наблюдава намаляване на степента на хидратация на разтворените вещества и тяхното съчетаване в по-големи частици, които се утаяват.
Ултразвуковото третиране на водата води и до образуването на по-големи частици от разтворени вещества с образуването на утайка.
Препоръчително е да разгледаме подробно метода на йонообмен и обратната осмоза във втората част на статията, която ще публикуваме в нашето списание в следващия брой.
