صلابة المياه والقضاء عليها. المهام والتمارين للمعادن من المجموعة الفرعية iA
الصفحة 1
ويتم القضاء على صلابة مؤقتة من الماء المغلي. عند الغليان ، يتم تدمير المواد الهيدروكربونية ، وتتشكل الكربونات شديدة الذوبان. عندما يتم إدخال كربونات الصوديوم ، هيدروكسيد الكالسيوم في الماء ، تتم إزالة الصلابة الكلية للمياه. في هذه الحالة ، يتم التخلص من صلابة كربونات بواسطة الجير ، ويتم التخلص من صلابة غير كربونات بواسطة الصودا.
بالإضافة إلى التخلص من الصلابة المؤقتة ، يرسب الجير كل المغنيسيوم والحديد من الماء ويعزز تخثر المواد الغروية العضوية وغير العضوية.
بعد تنظيف الشوائب ، والتخلص من الصلابة المؤقتة والصرف ، يتم إدخال ماء المكياج في المبادل الحراري (2) ، حيث يتم تسخينه إلى 335 كلفن. بعد الخلط ، يتم ضخ ماء المكياج والعودة إلى المنطقة الثانية من المبادل الحراري (2) ، حيث يتم تسخينه إلى 355 كلفن شبكات التدفئة.
غالبًا ما يستخدم التليين للتخلص من صلابة المياه المؤقتة ، المصممة للتعويض عن الخسائر (إعادة الشحن) في أنظمة الإمداد بالمياه المغلقة المغلقة ولمنع تلوث المعادن بأسطح التبادل الحراري والتبريد الملامسة للماء المتداول. في كثير من الحالات ، يكون ماء المكياج هو المصدر الرئيسي لتراكم أيونات الكالسيوم والكربونات الحيوية في المياه المتداولة ، والتي في الأنظمة التي تحتوي على معاملات تبخر عالية يمكن أن تعطل التكوين المستقر للمياه المتداولة.
يتم تليين الماء من أجل القضاء على الصلابة المؤقتة كيميائياً عن طريق إدخال الكواشف ، التي تستخدم كحامض الجير أو الكبريتيك أو الهيدروكلوريك. الطرق الكيميائية تحقيق تليين المياه الضحلة نسبيا. للحصول على درجة أعلى من التليين ، يتم استخدام طرق تبادل الكاتيون ، والتي يتمثل جوهرها في استخدام قدرة بعض المواد على تبادل كاتيونات الصوديوم الموجودة فيها للحصول على كاتيونات من أملاح الصلابة في الماء.
يتم استخدام الصودا الكاوية في محطات الطاقة الحرارية للتخلص من الصلابة المؤقتة للمياه ، لتجديد المرشحات الأنوفيتية المستخدمة في النباتات لتحلية المياه الكيميائية.
تستخدم الصودا الكاوية في محطات الطاقة الحرارية للتخلص من صلابة المياه المؤقتة وتجديد المرشحات الأنيونية المستخدمة في محطات التحلية الكيميائية.
وبالمثل ، ينبغي أيضًا حساب كمية الكالسيوم (OH) 2 اللازمة لإزالة الصلابة المؤقتة.
لماذا ، للقضاء على تصلب مؤقت بسبب أملاح المغنيسيوم ، هناك حاجة إلى المزيد من الجير من للقضاء على صلابة مؤقتة بسبب أملاح الكالسيوم.
لذلك ، لإعادة شحن أنظمة الإمداد بالمياه المغلقة (الخالية من التطهير) ، يجب إجراء تليين عميق نسبياً لمياه الماكياج والقضاء على الصلابة المؤقتة.
يؤدي إدخال كميات صغيرة من الكواشف القلوية إلى زيادة كفاءة المعالجة المغناطيسية للمياه ، على الرغم من أن إدخال الكواشف القلوية ، على سبيل المثال ، الجير بكميات لا تزيد عن 10 - 20٪ من تلك الضرورية لإزالة الصلابة المؤقتة ، وفقًا للدراسات التي أجريت في KhIEI في عام 1959 ، يقلل من تكوين المقياس. 8 الى 10 مرات.
في هذه الحالة ، يتم التخلص من المياه الستة العظام التي تسببها بيكربونات. لذلك ، تسمى هذه الصلابة مؤقتة ، أو بيكربونات. لذلك ، للقضاء على الصلابة المؤقتة ، يكفي غلي الماء.
لا يتم إزالة أملاح الصلابة المستمرة ، على سبيل المثال ، CaCl ، CaSO4 ، وما إلى ذلك ، من الماء عند تسخينها. يتم ترسبها أثناء تبخر الماء ، وتتشكل على جدران الجهاز الصعب إزالة النطاق الكثيف. لا يمكن استخدام الماء العسر إلا في الحالات التي لا تتسبب فيها ظروف استخدامه في ترسيب رواسب صلبة ، على سبيل المثال ، في الثلاجات التي لا تسخن فيها مياه التبريد لدرجة حرارة تساعد على التخلص من الصلابة المؤقتة. في محطات الغلايات ، حيث لا يتم تسخين المياه فحسب ، بل يتبخر أيضًا ، ليس فقط مؤقتًا ، ولكن أيضًا صلابة ثابتة أمر غير مقبول. لذلك ، يتم تنقية الماء بالنسبة لهم من أملاح الكالسيوم والمغنيسيوم بطريقة كيميائية في النباتات الخاصة.
مؤسسة تعليمية بلدية
"المدرسة الثانوية رقم 1
مع دراسة متعمقة للمواضيع الفردية
العنوان: منطقة بيلغورود ،
اختبار صلابة المياه
وطرق القضاء عليه
الطالب 11 "A" فئة مذكرة التفاهم "متوسط
المدرسة الثانوية رقم 1
مع دراسة متعمقة
العناصر الفردية
العنوان: منطقة بيلغورود ،
المستشار العلمي:
مدرس كيمياء
المدرسة الثانوية رقم 1
مع دراسة متعمقة
العناصر الفردية
نوفي أوسكول ، منطقة بيلغورود
العنوان: منطقة بيلغورود ،
نوفي أوسكول ،
نوفي أوسكول
1. مقدمة .................................................................. 3
2. صلابة المياه وطرق القضاء عليها ..............................
لماذا يصبح الماء صعبًا ..............................................................
· قيمة صلابة الماء في حياة الإنسان ...................................... 4
· طرق القضاء على الصلابة .................................
3. دراسة صلابة المياه وطرق القضاء عليها .............. ... 8
4. الخلاصة والاستنتاجات
5. قائمة المراجع
مقدمة
من درس العلوم ، لكن لا يطبقها ،
على غرار الشخص الذي حرث ، لكنه لا يزرع.
السعدي
في ثمانينيات القرن العشرين ، ظهرت كتب بول شابيوس براغ حول الترويج لنمط حياة صحي. وعلى الرغم من أن العديد من العلماء يعتبرون أن رأيه مثير للجدل ، إلا أن كتب بول براج تستحق الاهتمام. يخصص أحد أقسام كتابه (تجربتي الأولى مع الصلابة) لمشكلة صلابة المياه ، حيث يصف المؤلف في مذكراته مرض جده ، الذي مات من حقيقة أن أوعيةه الدموية أصبحت تحجرت من الماء العسر ، والمرأة التي عاشت في أجزائها ( كانت المرأة المؤسفة تسمى امرأة حجرية ، حيث أن جسدها كان تحفه حرفيا عدد كبير من الأملاح). كانت تلك المرأة واحدة من العديد من ضحايا الماء العسر. فشلت الأعضاء المؤسفة في التعامل مع كمية كبيرة من المواد غير العضوية الموجودة في مثل هذه المياه ، وبدأت تتراكم بنشاط كبير في جسمها.
تترسب مركبات الكالسيوم في أجسامنا في شكل حصوات الكلى والمرارة.
اليوم ، معالجة المياه ليست مجرد نزوة وتدليل ، بل هي ضرورة حيوية. والحقيقة هي أن هذه الظواهر غير السارة مثل حثالة ، صفعات طرف ثالث ، والروائح ، وكذلك وجود غائم يعجل ليس فقط تسبب الكثير من الإزعاج ، ولكن أيضا تسبب العديد من الأمراض. الماء منخفض الجودة يعزز ترسب الأملاح ، ويسرع عملية الشيخوخة في الجسم ، ويصبح السبب في انتقال العديد من الأمراض إلى المرحلة المزمنة. بالإضافة إلى ذلك ، يحتوي الكلور على عدد من المواد التي يمكن أن تسبب السرطان. لكن الماء هو أساس الحياة ولا يمكن لأي كائن حي أن يستغني عن الماء. على سبيل المثال ، الشخص يتكون من الماء بنسبة 60-65 ٪. لذلك ، المياه النظيفة أمر حيوي لكل شخص. لسوء الحظ ، فإن المياه الطبيعية في عصرنا غير مناسبة تمامًا للاستهلاك دون معالجة أولية ، وهو ما تؤكده التحليلات المختلفة للمياه. يعلم الجميع أن محطات الترشيح ، التي تنفذ عملية تنقية المياه المزعومة ، كانت بحاجة إلى إصلاحات كبيرة منذ فترة طويلة ، وأن أنظمة إمدادات المياه التي يتم من خلالها توصيل المياه إلى منازلنا تحتاج إلى استبدال.
كان هدف عملنا هو دراسة مستوى صلابة المياه في مسقط رأسنا.
صلابة المياه وطرق القضاء عليها
لماذا الماء يصعب
الكالسيوم ومركباته ضرورية للغاية للجسم: بعد كل شيء ، من الكالسيوم orthophosphate Ca3 (P04) 2 تتكون عظام وأسنان البشر والحيوانات. تتشكل من مركبات الكالسيوم القابلة للذوبان ، والتي تحمل الدم في جميع أنحاء الجسم. بفضل الكالسيوم الكالسيوم Ca2 + ، فإن الدم قادر على تخثر ، وتشكيل جلطات ، انسداد الجروح ووقف النزيف.
مركبات الكالسيوم ليست مفيدة فحسب ، ولكنها أيضًا ضارة جدًا - على سبيل المثال ، عندما تعطي صلابة للمياه العادية. في الحياة اليومية ، لا يمكن تطبيق كلمة "صلابة" ، للوهلة الأولى ، إلا على المواد الصلبة: يمكن أن يكون مقعد الحديقة أو البراز في المطبخ صلبًا. ومع ذلك ، المياه صعبة أيضا.
المصدر الرئيسي لأملاح المغنيسيوم والكالسيوم التي تدخل المياه هي رواسب الحجر الجيري والجبس والدولوميت التي تتآكلها المياه الطبيعية.
في المياه قليلة الملوحة ، معظم أيونات الكالسيوم. مع زيادة درجة التمعدن ، ينخفض \u200b\u200bمحتوى أيونات الكالسيوم بسرعة ونادراً ما يتجاوز 1 غرام / لتر. يمكن أن يصل محتوى أيونات المغنيسيوم في المياه المعدنية إلى عدة جرامات ، وفي المياه المالحة عدة عشرات من الجرامات.
صلابة الماء - مزيج من الخواص الكيميائية والفيزيائية للماء المرتبطة بمحتوى الأملاح الذائبة من المعادن الأرضية القلوية فيه ، خاصة الكالسيوم والمغنيسيوم. الماء ذو \u200b\u200bالمحتوى العالي من هذه الأملاح يسمى الماء العسر ، مع نسبة منخفضة من اللين. هناك صلابة مؤقتة (كربونات) تتكون من الهيدروكربونات وتصلب دائم (غير كربونات) ناتج عن وجود أملاح أخرى. الصلابة المؤقتة ناتجة عن وجود كربونات الكالسيوم والمغنيسيوم (Ca (HCO3) 2 ؛ Mg (HCO3) 2) في الماء. ترجع صلابة الماء الثابتة إلى وجود الكبريتات في كلوريد الكالسيوم والكالسيوم والميغرام في الماء (CaSO4 ، CaCl2 ، MgSO4 ، MgCl2).
قيمة صلابة المياه في حياة الإنسان
صلابة الماء هي مجموع أيونات الكالسيوم Ca2 + والمغنيسيوم Mg2 + المذاب في الماء.
لا تسبب أيونات الكالسيوم والمغنيسيوم ضررًا كبيرًا للكائنات الحية ، لكن وجودها في الماء بكميات كبيرة أمر غير مرغوب فيه ، لأن هذه المياه غير مناسبة للاحتياجات المنزلية.
في الماء العسر ، يزداد استهلاك الصابون والمسحوق عندما يتم هضم ملابس الغسيل واللحوم والخضروات ببطء ، كما تقل حركة المعدة. الماء العسر غير مناسب لأنظمة إمدادات المياه ومعدات تسخين المياه.
تقاس الصلابة بمعادل ملليغرام لكل لتر (mEq / L). تعتمد معايير الصناعة الخاصة بقيم الصلابة المسموح بها على نوع المعدات المستخدمة. عادة ، يعتبر الماء العسر مع صلابة 1 mEq / L أو أكثر.
الصلابة هي مشكلة جودة المياه الأكثر شيوعا. في الأصل ، تم تطبيق مصطلح "الماء العسر" على الماء الذي كان من الصعب غسله.
الماء العسر ، عند غسله ، يجفف الجلد ، وتكون الرغوة فيه سيئة عند استخدامه للصابون. يؤدي استخدام الماء العسر إلى ظهور الرواسب (الحجم) على جدران الغلايات ، في الأنابيب ، إلخ. في الوقت نفسه ، يمكن أن يؤدي استخدام الماء الرقيق للغاية إلى تآكل الأنابيب ، حيث لا يوجد في هذه الحالة تخزين مؤقت للحامض يوفره الهيدروكربونات (مؤقت) تصلب. عادةً ما لا يمثل استهلاك الماء العسر أو اللين خطراً على الصحة ، على الرغم من وجود أدلة على أن الصلابة العالية تساهم في تكوين حصوات المسالك البولية ، وتؤدي إلى انخفاض خطر الإصابة بأمراض القلب والأوعية الدموية بشكل طفيف.
يمكن أن تختلف صلابة المياه الطبيعية على نطاق واسع وغير مستقرة على مدار العام. تزداد صلابة بسبب تبخر الماء ، يتناقص خلال موسم الأمطار ، وكذلك أثناء ذوبان الثلوج والجليد.
طرق للقضاء على تصلب
تميز شامل تصلب ، والذي يتكون من مؤقت و دائم.
الغليان.
مؤقت تصلب (يمكن التخلص منها أو كربونات) بسبب وجود كربونات الكالسيوم (HCO3) 2 و Mg (HCO3) 2 في الماء. صلابة الكربون سهلة لإزالة الماء المغليحيث تتم إزالة Ca2 + و Mg2 + لتشكيل رواسب غير قابلة للذوبان:
Ca (HCO3) 2 CaCO3 ↓ + CO2 + H2O
تترسب أيونات المغنيسيوم في شكل كربونات أساسية أو في شكل هيدروكسيد المغنسيوم (عند درجة الحموضة\u003e 10.3).
2Mg2 + + OH) 2CO3 ↓ + CO2 + H2O
(تتشكل الأيونات بسبب تفاعل الأيونات مع الماء: وينتقل التوازن إلى اليمين عند تسخينه).
للحد من صلابة الكربونات طريقة التجيير حيث يتم إدخال المياه المعالجة كلسكاليفورنيا (أوهايو) 2. يمكن كتابة التفاعلات التي تحدث مع إدخال الجير في شكل جزيئي:
Ca (HCO3) 2 + Ca (OH) 2 → 2CaCO3 ↓ + H2O
Mg (НСО3) 2 + Са (ОН) 2 → Mg (ОН) 2 ↓ + 2СаСО3 + Н2О
يتم الحفاظ على صلابة ثابتة (غير قابلة للاسترداد أو غير كربونات) عند غليان الماء ، لأن الصلابة الثابتة ترجع إلى وجود الكبريتات والكلوريدات وأملاح الكالسيوم والأملاح الأخرى في الماء. من الناحية الكمية ، تساوي تركيز أيونات Ca2 + و Mg2 + مطروحًا منها صلابة الوقت. عادة ما تستخدم لتقليل صلابة الكربونات. المياه الغازية صودا الخبز (Na2CO3):
MgSO4 + Na2CO3 → MgCO3 ↓ + Na2SO4
بينما مضيفا العادم و المياه الغازية يمكنك التخلص من صلابة الكربونات وغير الكربونات ( طريقة الجير الصودا).
يتم التخلص من جميع الصلابة حتى مع إدارة فوسفات الصوديوم, رباعي الصوديوم نظرًا لأن الفوسفات هو أقل قابلية للذوبان من الكربونات ، فإن استخدامه في تليين المياه أكثر ملاءمة:
3CaSO4 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 3Na2SO4
تعتمد الطريقة الحديثة لتليين المياه على استعمال راتنجات التبادل الأيوني - المبادلات الأيونية (مبادلات الكاتيون ومبادلات الأنيون). مبادلات الكاتيون هي راتنجات التبادل الأيوني الاصطناعية - ألومينوسيليكات ، على سبيل المثال:
يمكن التعبير عن تركيبها بشكل مشروط من خلال الصيغة العامة Na2R ، حيث Na + هو كاتيون متنقل للغاية و R - هو جسيم مبادل الكاتيون الذي يحمل شحنة سالبة.
عندما يتدفق الماء العسر عبر طبقة من راتينج التبادل الكاتيوني ، يتم تبادل الكاتيونات وفقًا لردود الفعل:
Ca2 + + Na2R → 2Na + + CaR
Mg2 + + + Na2R → 2Na + + MgR
وهكذا ، تمر أيونات Ca2 + و Mg2 + من المحلول إلى راتينج التبادل الكاتيوني. لاستعادة راتنج التبادل الكاتيوني ، يتم غسله بمحلول مركّز من NaCl:
CaR + 2NaCl → CaCl2 + Na2R
بعد الغسيل ، يمكن استخدام راتنج تبادل الكاتيون مرة أخرى لإزالة الصلابة من الماء.
التناضح العكسي. تعتمد هذه الطريقة على مرور الماء عبر أغشية نصف نافذة (عادةً من مادة البولياميد). جنبا إلى جنب مع أملاح صلابة ، تتم إزالة معظم الأملاح الأخرى أيضا. كفاءة التنظيف يمكن أن تصل إلى 99.9 ٪. وجدت هذه الطريقة أكبر تطبيق في أنظمة معالجة مياه الشرب المنزلية. كمساوئ لهذه الطريقة ، يجب الإشارة إلى الحاجة إلى التحضير الأولي للمياه المزودة بغشاء التناضح العكسي.
الكهربي. يعتمد على إزالة الأملاح من الماء عن طريق عمل مجال كهربائي. تحدث إزالة أيونات المواد المذابة بسبب الأغشية الخاصة. كما هو الحال مع تقنية التناضح العكسي ، تتم إزالة الأملاح الأخرى ، بالإضافة إلى أيونات الصلابة.
الطريقة الحرارية. بناءً على تسخين المياه ، يزيل الصلابة المؤقتة (كربونات) فقط. يجد التطبيق في الحياة اليومية. في الصناعة يتم استخدامه ، على سبيل المثال ، في محطات الطاقة الحرارية.
تليين الكاشف. وتستند هذه الطريقة على إضافة الصودا أو الجير المائل إلى الماء. في هذه الحالة ، تنتقل أملاح الكالسيوم والمغنيسيوم إلى مركبات غير قابلة للذوبان ، وبالتالي تترسب. هذه الطريقة لها ما يبررها في استهلاك المياه المرتفع نسبياً ، لأنها مرتبطة بحل عدد من المشاكل المحددة: تصفية الرواسب ، جرعة دقيقة من كاشف.
تبادل الأيونات الموجبة. تعتمد الطريقة على استخدام التحميل الحبيبي لتبادل الأيونات (في معظم الأحيان راتنجات التبادل الأيوني). هذا الاتصال ، عند ملامسة الماء ، يمتص الكاتيونات من أملاح الصلابة (الكالسيوم والمغنيسيوم). في المقابل ، اعتمادا على الشكل الأيوني ، التخلي عن أيونات الصوديوم أو الهيدروجين. تسمى هذه الطرق على التوالي Na-cation و H-cation. وكقاعدة عامة ، تتناقص صلابة الماء مع الكاتيون الصوديوم أحادي الطور إلى 0.05 - 1.1 متر مكعب / لتر ، مع مرحلتين - إلى 0.01 متر مكعب / لتر.
أفضل كاشف للتخلص من صلابة المياه العامة ، فإن فوسفات الصوديوم هو Na3PO4: 3Ca (HCO3) 2 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 6NaHCO3 3MgSO4 + 2Na3PO4 → Mg3 (PO4) 2 ↓ + 3Na2SO4 very poor poor poor poor poor تليين المياه أفضل. في الصناعة ، يتم استبدال أيونات الصوديوم والبوتاسيوم باستخدام مرشحات التبادل الأيوني وأيونات الكالسيوم والمغنيسيوم لإنتاج الماء العسر. يحدث تليين معين للمياه في المرشحات المنزلية لمياه الشرب. الماء المصفى يعطي نطاق أقل. يمكن تنقية المياه بالكامل بالتقطير (التقطير).
اليوم هناك ممتاز مرشحات المياه التي يتم تثبيتها في الشقة دون مشاكل وتعمل كأداة ممتازة لمعالجة المياه عالية الجودة. ربما يفضل الكثيرون اليوم شراء المياه النقية المعبأة في زجاجات في محلات السوبر ماركت. اختيار هذه المياه ضخم حقًا ، لكن هل من الممكن أن تكون متأكداً 100٪ من جودته؟ ربما لا! وهذا هو السبب في أن تنقية المياه بمساعدة المرشحات المصممة خصيصًا لتنقية المياه هي الحل الأمثل لشخص عصري يهتم بصحته وصحة أحبائه. أنظمة تنقية المياه متنوعة جدا. وكقاعدة عامة ، فهي تختلف: الأداء ، وبعض المعايير ، ودرجة تنقية المياه ، وكذلك التصميم. مرشحات المياه تنظف المياه تمامًا وتجعلها مناسبة للشرب ، وتقلل من محتوى الألمنيوم والحديد والمنغنيز والكلور وجميع أنواع النترات فيه. بالإضافة إلى ذلك ، تساعد فلاتر تنقية المياه على التخلص من الرائحة الكريهة والذوق والتخلص من الجراثيم والبكتيريا الموجودة في الماء. الماء الذي تم تنقيته من خلال هذه النظم يصبح أقل صلابة ، ومع ذلك ، فإنه لا يفقد المواد المفيدة الضرورية لجسم الإنسان. تعتبر فلاتر المياه فرصة ممتازة لتلقي المياه النقية بكميات غير محدودة دون مغادرة منزلك. المرشح الذي تم اختياره بشكل صحيح سيكون حلاً ممتازًا لمشكلة المياه النظيفة ، ويحسن الصحة ويمدد طول العمر.
دراسة صلابة المياه وطرق القضاء عليها
صلابة الماء ناتجة عن وجود أيونات Ca2 + و Mg2 +. كلما زاد محتواها في المياه الطبيعية (المياه التي تمر عبر الصخور الجيرية والتربة) ، زادت صلابتها.
من الناحية الكمية ، يتم التعبير عن صلابة المياه كمجموع الألف من أيونات Ca2 + و Mg2 + الموجودة في لتر واحد من الماء (meq / l). يناظر نصف ميلي من الصلابة محتوى 20.04 ملغم / لتر من أيونات Ca2 + أو 12.16 ملغم / لتر من أيونات Mg2 +.
لذلك ، عند حل المشكلات ، يمكنك استخدام الصيغة:
(مليمول - equiv / ل) ،
حيث م - كتلة المادة التي تجعل صلابة الماء أو تستخدم للقضاء على صلابة المياه ، ملغ ؛
ماي- الكتلة المكافئة لهذه المادة ، g / mol ؛
V- حجم الماء ، ل
بواسطة صلابة ، وتنقسم جميع المياه الطبيعية إلى ناعم(صلابة الكلية أقل من 2 مليمول / لتر) و قاسيمع متوسط \u200b\u200bدرجة الصلابة (2-10 مليمول / لتر) ودرجة عالية من الصلابة (أكثر من 10 مليمول / لتر).
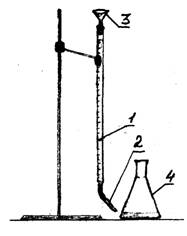
1 - السحاحة
2 - قطارة
3 - قمع
الشكل 1 - الإعداد التجريبي
تجربة الأداء
في ثلاثة قوارير ، وقياس مع اسطوانة كبيرة تدرج 100 مل من الماء. أضف 2-3 قطرات من مؤشر برتقال الميثيل إلى كل قارورة بالماء. ويتم المعايرة من 0.1 ن. حل حمض الهيدروكلوريك باستخدام السحاحة. اضبط مستوى الحمض في السحاحة على انقسام صفري. اسكب حمض الهيدروكلوريك قطرة قطرة حتى يتغير لون المحلول من الأصفر إلى البرتقالي الوردي. سجل كمية الحمض التي دخلت في المعايرة. كرر المعايرة مرتين أخريين. أدخل البيانات في الجدول.
يتم الحساب وفقًا للصيغة:
![]() (مليمول - equiv / ل) ،
(مليمول - equiv / ل) ،
أين هو التركيز الطبيعي لحمض الهيدروكلوريك؟
Vcp ( حمض الهيدروكلوريك) - متوسط \u200b\u200bالحجم حمض الهيدروكلوريك، ذهب للمعايرة.
Vwater - حجم المياه التي اتخذت للمعايرة.
البيانات التي تم الحصول عليها قمنا بتصميمها في شكل جدول.
عينة المياه
تستخدم لالمعايرة
تستخدم لمعايرة المياه المصفاة
ماء الصنبور - مجلس الوزراء الكيمياء
ماء من الصنبور - ش. طيران
ماء من الصنبور - ش. أكتوبر
المياه من العمود - ص الساحلية
ماء من الصنبور - ش. بوكروفسكي
ماء من البئر. بوكروفسكي
ماء من الصنبور - ش. بيلغورود
ماء من الصنبور - ش. جندي
الماء الغازي "جميل"
في ظروف المختبر المدرسي ، أجرينا دراسة للمياه المأخوذة من مصادر مختلفة للصلابة. لتحديد صلابة ، تم استخدام معايرة المياه الطبيعية مع حمض الهيدروكلوريك في وجود مؤشر على برتقال الميثيل. تم تحديد صلابة الكربونات لعينة المياه قبل وبعد تمريرها عبر مرشح منزلي (تم استخدام أكوافور).
نتيجة للعمل ، تم تقديم الاستنتاجات التالية:
1) المياه في مدينة نوفي أوسكول صعبة (وزن \u003d 7-10.5). يعيش الكثير من الناس في القطاع الخاص ويستخدمون المياه من الآبار ، وهذه المياه صعبة للغاية.
2) يتعرض الماء الداخل لإمدادات المياه للتنقية والتليين (L \u003d 6-7) ، وبالتالي يمكن اعتباره صلابة متوسطة (وفقًا لـ GOST ، يجب ألا تتجاوز الصلابة الكلية لمياه الشرب أكثر من 7 مليمول / لتر).
3) أسهل طريقة منزلية لتليين المياه هي الغليان التقليدي.
4) أظهرت التجارب أن المرشحات المنزلية تعمل أيضًا على تليين الماء تمامًا. لذلك ، المياه المأخوذة للبحث من البئر على المجاهدين. بوكروفسكي (صلابة 10.5 مليمول / لتر) ، بعد التصفية ، كان لديه صلابة فقط 2 مليمول / ل ، وهو أقل حتى من القاعدة الفسيولوجية (3.5 مليمول / لتر). وبالتالي ، تعد مرشحات المياه فرصة ممتازة لتلقي المياه النقية بكميات غير محدودة دون مغادرة منزلك.
قائمة المراجع
1.،. دليل لتمارين النظافة العملية مع تقنية البحوث الصحية. - م: "الطب" ، 19s.
2. و. أساسيات التحليل الكيميائي. دليل الدراسة للطلاب. - م: "التنوير" ، 1971. - 192 ص.
3. كيمياء غير عضوية: كتاب مدرسي. ل تقني المواصفات. الجامعات. - م: العالي. المدرسة. ، 1989. - 432 صفحة.
4،. نراقب بيئة مدينتنا: الصفوف 9-11: ورشة المدرسة. - م: الإنسانية. أد. مركز فلادوس ، 2001. - 112 ص.
5. الكيمياء: المرجع. أد. / B. شروتر ، ك. Lautenschleger، H. Bibrak et al .: Per. معها._ م .: الكيمياء ، 1989. - لكل. ed.: GDR، 1986.- 648 p.
سلاسل التحول
1. كربونات الكالسيوم أكسيد الكالسيوم هيدروكسيد الكالسيوم كربونات الكالسيوم نترات الكالسيوم.
2. كبريتات المغنيسيوم نترات المغنيسيوم أكسيد المغنيسيوم خلات المغنيسيوم.
3. كلوريد الكالسيوم كبريتات الكالسيوم كبريتات الكالسيوم كبريتات الكالسيوم هيدروكسيد الكالسيوم أكسيد الكالسيوم هيدروكربونات الكالسيوم.
4. المغنيسيوم أكسيد المغنيسيوم هيدروكسيد المغنيسيوم كلوريد المغنيسيوم هيدروكسي كربونات المغنيسيوم كبريتات المغنيسيوم هيدروكسيد المغنيسيوم.
5. كبريتيد المغنيسيوم أكسيد المغنيسيوم ... هيدروكسيد المغنيسيوم ... نترات المغنيسيوم.
6. الكالسيوم هيدروكسيد الكالسيوم كربونات الكالسيوم أكسيد الكالسيوم كربيد الكالسيوم هيدروكسيد الكالسيوم هيدروكربونات الكالسيوم.
مهام التسوية
المستوى أ
1. تفاعل 13.7 جم من المعدن مع الماء يطلق 2.24 لتر من الغاز (غير معروف). تحديد المعدن. ما الذي يترسب وبأي كمية تتشكل إذا تم إضافة فائض من سلفات الصوديوم إلى المحلول الناتج؟
قرار
يتم إطلاق الغاز (H 2) أثناء تفاعل المجموعات الفرعية M Ia و IIa مع الماء.
وفقًا لقانون المكافئات:
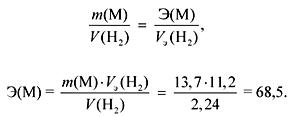
إذا كان M Ia مجموعات فرعية ، إذن
A ص (M) \u003d E التكافؤ \u003d 68.5 (لا يوجد مثل هذا المعدن).
إذا M IIa مجموعات فرعية ، ثم
A ص (M) \u003d E التكافؤ \u003d 137 (با).
Ba + 2H 2 O \u003d Ba (OH) 2 + H 2 ،
Ba (OH) 2 + Na 2 SO 4 \u003d BaSO 4 + 2NoOH ،
(BaSO 4) \u003d (Ba (OH) 2) \u003d (Ba) \u003d\u003d 0.1 مول ،
م(باسو 4) \u003d M\u003d 0.1 233 \u003d 23.3 جم.
الجواب. المعادن - با. م(باسو 4) \u003d 23.3 جم.
2. ما حجم 0.5 م محلول هيدروكسيد الكالسيوم الذي يجب إضافته إلى 81 جم من محلول 10٪ (الكثافة 1 جم / سم 3) من بيكربونات الكالسيوم لاستكمال تكوين الرواسب؟ تحديد كتلة الرواسب.
الجواب. 100 مل من Ca (OH) 2 ، 10 جم من CaCO 3.
3. تأثر المحلول الذي يحتوي على 23.3 جم من خليط من كبريتات البوتاسيوم والكرومات بزيادة في كلوريد الباريوم. ترشح المادة المترسبة وتغسل ، ثم يضاف إليها فائض من حمض الهيدروكلوريك. تم إذابة جزء من الترسبات ، وتم ترشيح الجزء المتبقي وغسله وتجفيفه. كانت كتلة المادة المترسبة بعد التجفيف 23.3 جم ، وحدد تركيبة الخليط الأولي.
الجواب. 17.4 جم من K 2 SO 4 و 5.9 جم من K 2 CrO 4.
4. هناك مزيج من الكالسيوم وأكسيد الكالسيوم وكربيد الكالسيوم مع نسبة المولي من مكونات 1: 3: 4 (بترتيب الإدراج). ما حجم الماء الذي يمكن أن يدخل في تفاعل كيميائي مع 35 غرام من هذا الخليط؟
الجواب. 17.568 مل.
5. الذوبان في هيدروكسيد السترونتيوم في الماء عند 100 درجة مئوية هو 28 جم ، وعند 25 درجة مئوية - 1 غرام لكل 100 غرام من الماء. تم تبريد 200 غرام من محلول هيدروكسيد السترونتيوم المشبع عند 100 درجة مئوية إلى 25 درجة مئوية. العثور على كتلة من هيدروكسيد السترونتيوم ثماني الهيدرات عجلت عندما تم تبريد المحلول.
الجواب. 93.08 غرام Sr (OH) 2 8H 2 O.
المستوى ب
1. تم تحميص كتلة معينة من كربونات المغنيسيوم البلوري حتى توقف تطور الغاز. تم تمرير هذه الأخيرة من خلال زجاجات التنظيف مع حمض الكبريتيك المركز وماء الجير. زادت كتلة القارورة الأولى بنسبة 1.8 غرام ، وفي الثانية 2 غرام من الترسبات سقطت. تحديد تكوين بداية هيدرات البلورية وكتلتها.
الجواب. MgCO 3 5H 2 O pentahydrate؛ 3.48 غ
2. نسبة المولي من كربونات ، بيكربونات ونترات الكالسيوم في خليط يزن 100 غرام هي 1: 2: 3 (بترتيب الإدراج). ما الحجم عند 1200 درجة مئوية والضغط الطبيعي الذي ستأخذه منتجات التحلل الغازي لهذا الخليط؟
قرار
معادلات تفاعلات التحلل لمكونات الخليط:
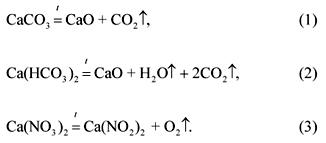
بشرط المشكلة:
(CaCO 3): (Ca (HCO 3) 2): (Ca (NO 3) 2) \u003d 1: 2: 3.
واسمحوا (CaCO 3) \u003d س الخلد.
ثم (Ca (HCO 3) 2) \u003d 2 س;
(كاليفورنيا (رقم 3) 2) \u003d 3 س;
100س + 162 2س +164 3س \u003d100,
س 0.109 مول.
في ص \u003d 101.3 كيلو باسكال و تي \u003d 1200 درجة مئوية في الحالة الغازية يتم إصداره:
CO 2 وفقًا للمعادلة (1):
1 (CO 2) \u003d (CaCO 3) \u003d س \u003d 0.109 مول ؛
H 2 O ، CO 2 وفقًا للمعادلة (2):
2 (H 2 O) \u003d (Ca (HCO 3) 2) \u003d 2 س \u003d 0.218 مول ،
2 (CO 2) \u003d 2 (Ca (HCO 3) 2) \u003d 4 س \u003d 0.436 مول ؛
O 2 وفقًا للمعادلة (3):
3 (O 2) \u003d (Ca (NO 3) 2) \u003d 3 س \u003d 0.327 مول.
إجمالي عدد مولات منتجات التحلل الغازي:
0.109 + 0.218 + 0.436 + 0.327 \u003d 1.09 مول (غير معروف).
من معادلة حالة الغازات المثالية نجد الحجم:
الكهروضوئية = RT,
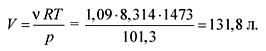
الجواب. V \u003d 131.8 لتر
3. تم تحضير خليط من الكميات المتساوية من هيدروكسيد فلز ثنائي التكافؤ وكربونات. تحولت كتلة المتبقي الصلب إلى 1.775 مرة أقل من كتلة الخليط الأولي. تمت إضافة 10 بقايا كبيرة من محلول حمض الكبريتيك إلى هذه البقايا. حساب جزء من كتلة المواد في الحل الناتج.
الجواب. 6 ٪ MgSO 4.
4. عند معالجة المياه بمزيج من هيدريد ونيتريد من معدن ثنائي التكافؤ مع كسور كتلة متساوية ، تم تشكيل خليط غاز بكثافة هيدروجين قدرها 2.658. اضبط المعدن الموجود في المركبات (لا تقرب الأرقام عند الحساب!).
الجواب. الكالسيوم.
5. أسقطت لوحة المغنيسيوم 16 جم في محلول 16 ٪ من كبريتات النحاس (II) التي تزن 350 غرام ، وعندما تمت إزالة اللوحة ، تبين أن الكتل الكتل للأملاح الموجودة في المحلول هي نفسها. كم مرة زادت كتلة لوحة؟
الجواب. 4.5 مرات.
مهام الجودة
1. أي من هذه المواد سوف تتفاعل مع هيدروكسيد المغنيسيوم: حمض الهيدروكلوريك ، حمض النيتريك ، ثاني أكسيد الكربون ، كلوريد الصوديوم ، هيدروكسيد الباريوم ، حمض الكبريتيك ، أكسيد النحاس (II)؟
الجواب. حمض الهيدروكلوريك ، HNO 3 ، H 2 SO 4.
2. في زجاجات بدون ملصقات هي الصودا والطباشير والجبس وكبريتات الصوديوم. كيف يمكن التعرف على هذه المواد بالماء وحمض النيتريك؟
الجواب.
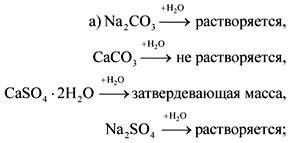
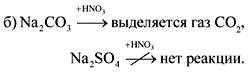
3. المادة أ هي معدن فضي فاتح شديد الصلابة. في تفاعل المادة A مع B ، وهي مادة غازية بسيطة ، يتم تكوين المركب C القابل للذوبان في الماء لتشكيل محلول قلوي. عند معالجة المادة باستخدام حامض الكبريتيك ، يتشكل الملح ، ويستخدم هيدرات البلورة في الطب لتطبيق الضمادات المثبتة للكسور. إعطاء معادلات رد الفعل.
الجواب. أ هو الكالسيوم ؛ B هي H 2 ؛ C هو CaH 2 ؛ هيدرات بلورية - CaSO 4 2H 2 O.
4. المادة أ هي أكسيد قابل للذوبان في الماء لتشكيل محلول قلوي. يتفاعل المركب B في هذا المحلول مع غاز عديم الرائحة C لتشكيل رسب أبيض ، يذوب تدريجياً مع مرور الغاز C. إعطاء معادلات التفاعل وتحديد المواد.
الجواب. A هو CaO ، باو ؛ B هو Ca (OH) 2 و Ba (OH) 2 ؛ C هو CO 2.
5. المادة أ ، وهي جزء من واحدة من أكثر المعادن شيوعا في قشرة الأرض ، تتحلل عند درجة حرارة عالية إلى اثنين من الأكاسيد ، واحدة منها تتكون دائما ب في عملية الحياة. عندما تتفاعل المادة B مع الجرافيت ، فعند تسخينها ، يصبح الغاز C ، السام للحيوانات ذات الدم الدافئ ، قابلاً للاشتعال وعديم اللون وعديم الرائحة. إعطاء معادلات التفاعلات ، وتحديد المواد.
الجواب. أ - كاك 3 B هو CO 2 ؛ C - CO.
صلابة المياه والقضاء عليها
ملخص الكيمياء
الموضوع:"صلابة المياه"
مقاول العمل:غرابين بافيل.
خطة
مقدمة 3
تحديد صلابة المياه. 3
تقنيات التقوية 4
المراجع 6
مقدمة
في الكهوف ، تجتمع الكهوف مع أجمل التكوينات من الحجر الجيري - الصواعد التي تتدلى من الأقواس والصواعد الصاعدة تنمو إلى الأعلى. من وجهة نظر الكيمياء ، فإن ظهور هذه الإبداعات المدهشة للطبيعة هو صلابة المياه الجوفية. نلتقي بمفهوم صلابة المياه ، ليس فقط في علم الكهوف والجيولوجيا ، ولكن بشكل عام وفي كل مكان - في الكيمياء والتكنولوجيا ، وحتى في الحياة اليومية. وبالتالي ، هذا المفهوم مهم جدا لتحديد نوعية المياه.
تحديد صلابة المياه
صلابة المياه - خاصية الماء (وليس لغسلها ، لإعطاء مقياس في الغلايات البخارية) المرتبطة بمحتوى مركبات الكالسيوم والمغنيسيوم القابلة للذوبان فيه ، وهذه معلمة توضح محتوى الكالسيوم والمغنيسيوم في الكاتيونات.
الصلابة هي الخصائص الخاصة للمياه ، والتي تحدد إلى حد كبير صفات المستهلك وبالتالي لها قيمة اقتصادية مهمة. تتشكل أشكال الماء العسر على جدران مراجل التدفئة والبطاريات وغيرها ، مما يؤدي إلى تدهور كبير في أدائها الحراري. هذه الطبقة الرفيعة على سطح التسخين ليست ضارة على الإطلاق ، حيث إن مدة التسخين خلال طبقة حثالة ، التي تتميز بموصلية حرارية منخفضة ، تزداد تدريجياً ، وينتهي القاع بشكل أسرع وأسرع - بعد كل شيء ، يبرد المعدن ببطء وبطيء في كل مرة ، ويظل في حالة تسخين لفترة طويلة. في النهاية ، قد يحدث أن قاع الوعاء لن يتحمل ويسمح بالتسرب. هذه الحقيقة خطيرة للغاية في الصناعة التي توجد فيها المراجل البخارية.
الماء العسر غير مناسب للغسيل. مقياس على سخانات الغسالات يضعهم خارج النظام ، كما أنه يزيد من سوء خصائص غسل الصابون. تتفاعل الكاتيونات Ca 2+ و Mg 2+ مع الأحماض الدهنية للصابون لتشكيل أملاح قليلة الذوبان تنتج أفلامًا وترسبات ، مما يقلل في النهاية من جودة الغسل ويزيد من استهلاك المنظفات ، أي رغو الماء العسر ضعيف
هناك نوعان من الصلابة: مؤقت ودائم. ويرجع هذا الاختلاف إلى نوع الأنيونات الموجودة في المحلول كموازنة للكالسيوم والمغنيسيوم.
صلابة مؤقتة المرتبطة بوجود في الماء جنبا إلى جنب مع الكاتيونات Ca 2+ ، Mg 2+ و Fe 2+ من الأنيونات الهيدروكربونية ، أو بيكربونات (HCO 3 -).
صلابة دائمة (أو غير كربونات) ينشأ إذا كانت الكبريتات والكلوريد والنترات والأنيونات الأخرى موجودة في المحلول ، وأملاح الكالسيوم والمغنيسيوم قابلة للذوبان جيدًا وبالتالي لا يمكن إزالتها. يتم تعريف الصلابة الكلية على أنها المحتوى الكلي لجميع أملاح الكالسيوم والمغنيسيوم في المحلول.
الدول المختلفة لديها معايير صلابة خاصة بها للمياه. في بلادنا ، يتم تصنيف المياه حسب الصلابة بهذه الطريقة:
الماء العسر مع صلابة أقل من 3.0 متر مكعب / لتر ،
صلابة متوسطة 3.0-6.0 mEq / L
صعب - أكثر من 6.0 mEq / مل.
طرق للقضاء على تصلب.
للتخلص من الصلابة المؤقتة تحتاج فقط إلى غلي الماء. عند غليان الماء ، تتفاعل الأنيونات الكربونية مع الكاتيونات وتشكل أملاح كربونات قليلة الذوبان بشكل سيء للغاية ، مما يترسب.
Ca 2 + 2HCO 3 - \u003d CaCO 3 ↓ + H 2 O + CO 2
مع أيونات الحديد ، يكون التفاعل أكثر تعقيدًا نظرًا لحقيقة أن FeCO 3 مادة غير مستقرة في الماء. في وجود الأكسجين ، يكون المنتج النهائي لسلسلة التفاعل هو Fe (OH) 3 ، وهو راسب أحمر غامق. لذلك ، كلما زاد عدد الحديد في الماء ، كلما كان اللون أقوى في المقياس ، والذي يتم ترسبه على جدران وأسفل الوعاء أثناء الغليان.
تصلب ثابت هو أصعب للقتال. خيار واحد: تجميد الجليد. تحتاج فقط إلى تجميد الماء تدريجيا. عند بقاء حوالي 10٪ من السائل من الكمية الأولية ، من الضروري تصريف المياه غير المجمدة وإعادة الجليد إلى الماء. جميع الأملاح ، التي تشكل صلابة ، تبقى في المياه غير المجمدة.
الغذاء هو طريقة واحدة - التقطير ، أي تبخر الماء بتكثيفه اللاحق. نظرًا لأن الأملاح عبارة عن مركبات غير متطايرة ، فإنها تبقى ، ويتبخر الماء.
لكن الطرق مثل التجميد والتقطير مناسبة فقط لتليين كمية صغيرة من الماء. الصناعة تتعامل مع طن. لذلك ، يتم استخدام أساليب أخرى. طريقة تبادل الكاتيون الأكثر استخدامًا ، بناءً على استخدام الكواشف الخاصة - مبادلات الكاتيون ، والتي يتم تحميلها في المرشحات وعندما يتم تمرير الماء من خلالها ، يستبدل الكاتيوم والمغنيسيوم بكاتيونات الصوديوم.
نتيجة لصلابة مقياس الماء ، من وجهة نظر الكيمياء ، يمكنك القتال بسهولة شديدة. من الضروري التأثير على ملح حمض ضعيف حامض أقوى. هذا الأخير يحل محل الفحم ، الذي ، غير مستقر ، يتحلل إلى الماء وثاني أكسيد الكربون. يمكن أن يشتمل تكوين المقياس على السيليكات والكبريتات والفوسفات. ولكن إذا قمت بتدمير "الهيكل العظمي" للكربونات ، فلن تبقى هذه المركبات على السطح.
كما يستخدم حمض الأديبيك وأنهيدريد المالئيك ، اللذين يضافان إلى الماء ، كعوامل لإزالة الترسبات. هذه المواد أضعف من حمض الكبريتيك ، لذلك فإن الغليان ضروري أيضًا لإزالة الترسبات.
المراجع:
Shpausus Z. السفر إلى عالم الكيمياء - موسكو: التعليم ، 1967. - 431s.
خارلامبوفيتش جي. كيمياء متعددة الجوانب. - م: التعليم ، 1992. - 159 ص.
خومشينكو جي. كتاب الكيمياء - م: الموجة الجديدة ، 1996. - 304 صفحة.
مقالات مماثلة:
دراسة خصائص المحاليل المخففة من polyarylates مع الأخذ في الاعتبار عاملين: التشكل من الجزيئات الكبيرة في الحل والترتيب التوجيهي لجزيئات المذيبات التي تحلها ، والتي تم الحكم عليها من خلال المعلمات الديناميكية الحرارية وهيكل المحلول.
الغرض وهيكل المرشحات الأيونية موازية دقيقة للمرحلة الأولى والثانية ، والعمل المختلط. توصيف تكنولوجيا التأين المعاكس. وصف طريقة الصوديوم الكاتيوني لتليين المياه. مبادئ تحلية المياه وتحلية المياه.
مبادلات الكاتيون وخصائصها. عملية تليين المياه عن طريق الموجبة الصوديوم. الهيدروجين والصوديوم الموجبة تبادل الماء المنقي. طرق الكاتيون الكاتيون والكاتيون الجزئي. مرشحات تبادل الكاتيون والأجهزة المساعدة لمنشآت تبادل الكاتيون.
ما هو الرغوة والسطحي. التوتر السطحي كأهم خصائص واجهة المرحلة. طرق الدراسات التجريبية لتأثير صلابة الماء على الرغوة وثبات الرغوة لأنواع مختلفة من الفاعل بالسطح.
خواص الماء وطرق تليينه. متطلبات صلابة المياه المستهلكة في صناعة الحرارة والطاقة. الأسس النظرية وطرق تحديد صلابة المياه باستخدام الطريقة المعقدة. أخذ العينات ، الكواشف ، تقرير.
إنتاج الكربون عن طريق التحلل الحراري للخشب ، وامتصاص المواد المذابة والغازات بواسطة الفحم. تفاعل ثاني أكسيد الكربون مع القلوي ، وإنتاج أول أكسيد الكربون ودراسة خصائصه. الإلمام بخصائص الكربونات والبيكربونات.
المؤشرات الشرطية لجودة مياه الشرب. تحديد المواد العضوية في الماء والنحاس وأيونات الرصاص. طرق للقضاء على صلابة المياه. طرق لتنظيف المياه. إعداد محلول عمل من كبريتات البوتاسيوم. تنقية المياه عن طريق التجميد الجزئي.
الخواص الكيميائية للكالسيوم. استخدام كربونات الكالسيوم النقية في البصريات ، والحجر الجيري في المعادن - كما تدفقات. الجبس كما هيدرات بلورات كبريتات الكالسيوم. ملح الكالسيوم من حامض الفوسفوريك هو العنصر الرئيسي في الفسفوريت والأباتيت.
مجموعة متنوعة من مركبات الكربون ، وتوزيعها في الطبيعة والتطبيق. تعديلات متآثر. الخصائص الفيزيائية وهيكل ذرة الكربون الحر. الخواص الكيميائية للكربون. كربونات وبيكربونات. هيكل الماس والجرافيت.
توصيف الغلاف الصخري وتكوين العناصر الكيميائية والمعادن في قشرة الأرض. هيكل والتركيب الكيميائي ووظائف الغلاف المائي والغلاف الجوي. ملامح التمثيل الضوئي للمواد العضوية التي تحدث في المحيط الحيوي. دراسة العمليات الجيوكيميائية الحيوية.
تؤثر صلابة الماء العالية في التدفئة وأنظمة المياه الساخنة المنزلية سلبًا على عمليات نقل الحرارة ، مما يزيد من استهلاك الطاقة. بالإضافة إلى ذلك ، مياه الشرب القاسية ضارة بصحة الإنسان. للمياه لأغراض مختلفة ، يتم استخدام طرق تليين مختلفة.
تليين المياه هو عملية إزالة أملاح الصلابة من الماء. ولكن ما هي صلابة المياه ولماذا يجب إزالتها؟
عادة ما يرتبط مفهوم صلابة الماء بكاتيونات الكالسيوم (Ca 2+) ، وبدرجة أقل ، المغنيسيوم (Mg 2+). في الواقع ، جميع الكاتيونات ثنائية التكافؤ إلى درجة أو أخرى تؤثر على تصلب. تتفاعل مع الأنيونات ، وتشكل مركبات (أملاح الصلابة) التي يمكن أن تترسب.
يمكن أن تترسب أملاح الحديد والمنغنيز والسترونتيوم أيضًا ، لكن في الممارسة العملية ، يكون لهذه العناصر تأثير صغير جدًا على الصلابة التي عادة ما يتم إهمالها.
يؤثر الألومنيوم (Al 3+) والحديد الحديدي (Fe 3+) أيضًا على الصلابة ، ولكن عند مستويات الأس الهيدروجيني الموجودة في المياه الطبيعية ، تكون قابلية ذوبانها وبالتالي "المساهمة" في الصلابة ضئيلة. وبالمثل ، لا يؤخذ تأثير الباريوم غير الهام (Ba 2+) في الاعتبار.
أنواع الصلابة
هناك عدة أنواع من صلابة المياه. يتم تحديد الصلابة الكلية بالتركيز الكلي لأيونات الكالسيوم والمغنيسيوم. وهو مجموع صلابة الكربونات (المؤقتة) وغير الكربونية (الدائمة).
ترجع صلابة الكربونات إلى وجود الهيدروكربونات والكربونات في الماء (عند درجة الحموضة\u003e 8.3). تتميز الصلابة المؤقتة بوجود الكاتيونات في الماء إلى جانب الكالسيوم 2+ و Mg 2+ و Fe 2+ من الأنيونات الهيدروكربونية أو بيكربونات (HCO 3-). يتم القضاء على هذا النوع من الصلابة تقريبًا بالكامل بواسطة الماء المغلي ولهذا السبب يطلق عليه الصلابة المؤقتة. عندما يتم تسخين الماء ، تتحلل الهيدروكربونات لتشكيل حمض الكربونيك وترسب كربونات الكالسيوم وهيدروكسيد المغنيسيوم والحديد.
الصلابة غير الكربونية ناتجة عن وجود أملاح الكالسيوم والمغنيسيوم للأحماض القوية (الكبريتيك ، النيتريك ، الهيدروكلوريك) ولا يتم التخلص منها بالغليان ، وبالتالي يطلق عليها صلابة ثابتة.
وحدات القياس
في الممارسة العالمية ، يتم استخدام عدة وحدات من الصلابة ، جميعها مرتبطة بطريقة معينة مع بعضها البعض.
تؤخذ وحدة الصلابة كصلابة للماء ، حيث تحتوي 1 لتر منها على 1 مليمول من مكافئات Ca 2+ أو Mg 2+. وحدة واحدة من الصلابة (1 مليمول / لتر) تقابل محتوى أيونات الكالسيوم التي تساوي 20.04 ميلي غرام لكل لتر أو أيونات المغنسيوم تساوي 12.15 ميلي غرام لكل لتر. يمكن حساب الصلابة الكلية للماء (H) بواسطة الصيغة:
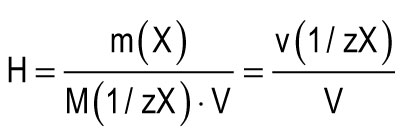
م (X) هي كتلة المادة المذابة ، ملغ. M (1 / zX) هي الكتلة المولية لما يعادل المادة ، mg / mmol (g / mol) ؛ الخامس هو حجم الماء ، ل ؛ م (1 / zCa 2+) \u003d 20.04 ملغ / مليمول ؛ م (1 / zMg 2+) \u003d 12.15 ملغم / مليمول.
بالإضافة إلى ذلك ، يتم استخدام وحدات الصلابة مثل الدرجات الألمانية (˚d، dH) والدرجة الفرنسية (˚f) والدرجة الأمريكية و ppm CaCO 3 على نطاق واسع في البلدان الأجنبية.
يتم عرض نسبة هذه الوحدات تصلب في الجدول. 1.
الجدول 1. نسبة وحدات مختلفة من تصلب
لذلك ، فإن درجة اللغة الألمانية تقابل 10 مجم / dm 3 CaO أو 17.86 mg / dm 3 CaCO 3 في الماء. درجة واحدة الفرنسية هي 10 ملغ / ديم 3 CaCO 3 في الماء ، والدرجة الأمريكية ما يعادل 1 ملغ / ديم 3 CaCO 3 في الماء.
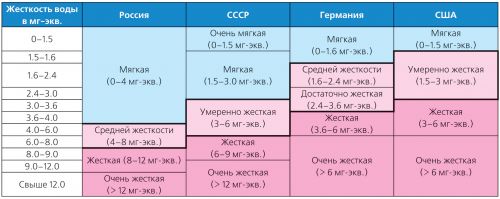
تختلف صلابة المياه على نطاق واسع وهناك أنواع كثيرة من التصنيفات. لذلك ، في ألمانيا ، يتم تطبيق معايير الصلابة للمعهد الألماني للتوحيد القياسي (DIN 19643) ، وفي الولايات المتحدة الأمريكية - التصنيف الذي اعتمدته وكالة حماية البيئة (USEPA) في عام 1986 (الجدول 2).
الجدول 2. تصنيف أنواع مختلفة من تصلب
أي ماء أكثر ليونة
عادة ، في المياه منخفضة المعادن ، تسود الصلابة بسبب أيونات الكالسيوم (على الرغم من أنه في بعض الحالات النادرة ، يمكن أن تصل صلابة المغنسيوم إلى 50-60 ٪). مع زيادة درجة التمعدن العام للمياه ، ينخفض \u200b\u200bمحتوى أيونات الكالسيوم (Ca 2+) بسرعة ونادراً ما يتجاوز 1 غرام / لتر. يمكن أن يصل محتوى أيونات المغنيسيوم (Mg 2+) في المياه شديدة التمعدن إلى عدة غرامات ، وفي البحيرات المالحة - عشرات غرامات لكل لتر من الماء.
بشكل عام ، صلابة المياه السطحية أقل بشكل عام من صلابة المياه الجوفية. تتعرض قساوة المياه السطحية لتقلبات موسمية ملحوظة ، وعادة ما تصل إلى أقصى قيمة لها في نهاية فصل الشتاء وأقلها خلال الفيضان ، عندما تكون مخففة بكثرة بالمطر الناعم والمياه الذائبة. مياه البحر والمحيط لها صلابة عالية للغاية (عشرات ومئات من م / ل).
عواقب تصلب
مياه الشرب الصلبة هي المرة بسبب طعم المغنيسيوم ولها تأثير سلبي على الجهاز الهضمي. وفقًا لمعايير منظمة الصحة العالمية (WHO) ، فإن الصلابة المثلى لمياه الشرب هي 1.0-2.0 mEq / l.
يتم هضم المنتجات الغذائية بشكل سيئ في الماء العسر ، حيث أن كاتيونات الكالسيوم مع بروتينات الطعام تشكل مركبات غير قابلة للذوبان ؛ يتم تخفيض قيمتها الغذائية. يمكن أن يؤدي الاستخدام المتواصل للماء العسر إلى ترسب الأملاح (مجرى البول) في جسم الإنسان.
يتم تخمير الشاي والقهوة بشكل سيئ في مثل هذه المياه. في الظروف المنزلية ، تؤدي الزيادة في أملاح الصلابة إلى تحجيم أسطح التسخين في الغلايات ، وأقداح الشاي ، والأنابيب ، وترسب الأملاح في تجهيزات السباكة وفشلها ، وترك رواسب على شعر الشخص وبشرته ، مما يخلق إحساسًا غير سارة بصلابته.
يتم تنظيم صلابة المياه المستخدمة لإعداد المنتجات المختلفة بشكل واضح وهي في مستوى 0.1-0.2 متر مكعب / لتر.
تتسع أشكال الماء العسر على جدران مراجل التدفئة والبطاريات ، وما إلى ذلك ، مما يضعف بشكل كبير أدائها الحراري ، ويقلل من القسم المجاني من خطوط الأنابيب.
تمتلئ خطوط الأنابيب برواسب كبيرة لدرجة أن إنتاجيتها تنخفض عدة مرات. لذلك ، في تلك العمليات التي يكون فيها استخدام الماء مع نسبة معينة من الملح مسموحًا به ، تقتصر صلابته على قيم أقل - 0.03-0.05 متر مكعب / لتر.
مقياس على سخانات الغسالات يضعهم خارج الترتيب. عند الغسيل ، والتفاعل مع المواد ذات النشاط السطحي (السطحي) من الصابون أو منظفات الغسيل ، فإن أملاح الصلابة تربطها وتحتاج إلى مزيد من الاستهلاك. لا يمكن استخدام الماء العسر عند تنفيذ عمليات تكنولوجية معينة ، على سبيل المثال ، أثناء الرسم ، في الكيمياء الكهربائية ، وهلم جرا.
إزالة الملح
تسمى عمليات استخراج أملاح Ca 2+ و Mg 2+ من الماء في معالجة المياه تليين الماء.
يمكن إجراء إزالة انتقائية نسبياً لأملاح الصلابة من الماء بطرق:
- المعالجة الحرارية.
- التقطير.
- تليين كاشف.
- التجميد؛
- المعالجة المغناطيسية.
- معالجة بالموجات فوق الصوتية.
- التبادل الأيوني
- التناضح العكسي.
طرق معالجة المياه معروفة أيضًا (التأثيرات الكهرومغناطيسية ، إضافة الفوسفات أو غيره من "المضادات") ، والتي تسمح "بربط" أملاح الصلابة لفترة من الوقت ، مما يمنعها من السقوط في شكل مقياس لبعض الوقت. ومع ذلك ، فإن هذه الطرق لا تحيد كيميائيًا أملاح الصلابة ، ولا تزيلها فعليًا ، وبالتالي وجدت استخدامًا محدودًا في معالجة المياه الصناعية.
تليين الحرارية
وبهذه الطريقة ، يتم التخلص من الصلابة المؤقتة الناتجة عن بيكربونات الكالسيوم والمغنيسيوم. عند غليان الماء ، تتحلل الهيدروكربونات لتشكيل رسب من كربونات متوسطة أو أساسية:
Ca (HCO 3) 2 \u003d CaCO 3 CO + CO 2 + H 2 O ،
Mg (HCO 3) 2 \u003d Mg 2 (OH) 2 CO 3 ↓ + 3CO 2 + H 2 O.
نتيجة لذلك ، يتم تقليل صلابة المياه. هذا هو السبب في صلابة بيكربونات يسمى مؤقت.
مع أيونات الحديد ، يكون التفاعل أكثر تعقيدًا نظرًا لحقيقة أن FeCO 3 مادة غير مستقرة في الماء. في وجود الأكسجين ، يكون المنتج النهائي لسلسلة التفاعل هو Fe (OH) 3 ، وهو راسب أحمر غامق. لذلك ، كلما زاد عدد الحديد في الماء ، كلما كان اللون أقوى في المقياس ، والذي يتم ترسبه على جدران وأسفل الوعاء أثناء الغليان.
وبالتالي ، عند غلي الماء في الحياة اليومية ، تحدث عملية تليين جزئي في وقت واحد.
التقطير
التقطير هو وسيلة تقليدية وفعالة وموثوقة توفر درجة عالية من تنقية المياه شديدة الملوحة ذات الملوحة العالية والصلابة.
المبدأ العام للحصول على الماء بهذه الطريقة هو كما يلي: تدخل مياه الشرب المعدة مسبقًا إلى وحدة التقطير ، والتي تتكون من ثلاثة مكونات رئيسية: المبخر ، والمكثف ، والمجمع.
يتم تسخين المبخر بالماء ليغلي. يدخل بخار الماء إلى المكثف ، حيث يتم تسييله وفي شكل نواتج التقطير ، يدخل المجمع. تبقى جميع الشوائب غير المتطايرة الموجودة في مصدر الماء في جهاز التقطير.
للحصول على مياه نقية ، يتم استخدام أجهزة التقطير التي تختلف عن بعضها البعض في طريقة التدفئة والإنتاجية وميزات التصميم.
طريقة التقطير الفردي غير اقتصادية ، لأنه عند استخدامها ، هناك تكاليف طاقة مرتفعة للتدفئة والتبخر (حوالي 3000 كيلو جول لكل 1 كجم من البخار) ، وكذلك استهلاك المياه لتكثيف البخار (حوالي 8 لترات من الماء 1 كجم من البخار). لذلك ، من المستحسن استخدام تقطير واحد لانخفاض استهلاك المياه - 10-20 لتر / ساعة.
أكثر كفاءة واقتصادية من تقطير التقليدية هي تقطير متعدد الأعمدة عالية الأداء. لكنها مكلفة للغاية ، إضافة إلى ذلك ، فإن تكاليف المعالجة المسبقة للمياه مرتفعة.
تجدر الإشارة إلى أن طريقة التقطير تزيل جميع الأملاح الذائبة في مصدر الماء.
تطبيق الكاشف
هناك تليين المياه عن طريق liming ، الصودا liming وطريقة الصودا الصوديوم المياه تليين.
عند التجيير ، يضاف الجير المائي Ca (OH) 2 إلى المحلول إلى درجة الحموضة حوالي 10. ونتيجة لذلك ، تستمر التفاعلات:
Ca (HCO 3) 2 + Ca (OH) 2 \u003d 2 CaCO 3 + 2H 2 O ،
Mg (HCO 3) 2 + 2Ca (OH) 2 \u003d Mg (OH) 2 + 2СaCO 3 + 2Н 2 O.
تُستخدم هذه الطريقة في صلابة عالية من الكربونات وانخفاض صلابة المياه غير الكربونية ، عندما يتطلب الأمر انخفاضًا متزامنًا في الصلابة والقلوية. تصلب المتبقي 0.4-0.8 mEq / L أعلى من صلابة غير كربونات.
عند إضافة الجير الصودا ، تضاف الجير المطحون Ca (OH) 2 والصودا Na 2 CO 3 إلى الماء إلى درجة الحموضة حوالي 10. ونتيجة لذلك ، تحدث التفاعلات التالية:
Ca (HCO 3) 2 + Ca (OH) 2 + Na 2 CO 3 \u003d 2 CaCO 3 + 2NaOH + H 2 CO 3 ،
Mg (HCO 3) 2 + 2NaOH \u003d Mg (OH) 2 + 2NaHCO
على النحو التالي من معادلات التفاعل ، في عملية تكوين وترسيب الرواسب من الماء ، يتم استخراج أملاح الصلابة. جنبا إلى جنب معهم ، تتم إزالة الجسيمات الغروية والمعلقة مع التلوث المرتبطة بها. يتم امتصاص الرواسب العضوية جزئيًا على رقائق الرواسب.
مع إزالة الصودا ، بسبب زيادة أيونات HCO 3 ، يتم تحقيق اكتمال أكبر لإزالة أملاح الصلابة من الماء. رفع درجة الحرارة إلى 70-80 درجة مئوية يتيح لك رفع الصلابة المتبقية إلى 0.35-1.0 متر مكعب / لتر. يمكن تحقيق نفس النتيجة عن طريق زيادة جرعات الكواشف.
طريقة الصودا الصودا
تعد إضافة الصودا ضرورية إذا كانت صلابة غير الكربونات أكبر من الكربونات. إذا كانت هذه المعلمات متساوية ، فقد لا تكون إضافة الصودا ضرورية على الإطلاق.
تشكل هيدروكربونات الكالسيوم والمغنيسيوم المتفاعلة مع القلويات مركبات ضعيفة الذوبان من الكالسيوم والمغنيسيوم والصودا والماء وثاني أكسيد الكربون:
Ca (HCO 3) 2 + 2NaOH \u003d CaCO 3 CO + Na 2 CO 3 + 2H 2 O،
Mg (HCO 3) 2 + 2NaOH \u003d Mg (OH) 2 ↓ + Na 2 CO 3 + H 2 O + CO 2.
يتفاعل ثاني أكسيد الكربون الناتج عن تفاعل كربونات هيدروجين المغنيسيوم مع القلويات مرة أخرى مع القلويات لتكوين الصودا والماء:
CO 2 + NaOH \u003d Na 2 CO 3 + H 2 O.
صلابة غير كربونات
تتفاعل كبريتات وكلوريد الكالسيوم مع الصودا المشكلة في تفاعلات صلابة الكربونات والقلويات وتضاف الصودا لتشكيل كربونات الكالسيوم التي لا تلتصق بالظروف القلوية:
CaCl 2 + Na 2 CO 3 \u003d CaCO 3 ↓ + 2NaCl ،
CaSO 4 + Na 2 CO 3 \u003d CaCO 3 ↓ + Na 2 SO 4.
تتفاعل كبريتات المغنيسيوم وكلوريد مع القلويات لتشكيل هيدروكسيد المغنيسيوم عجل:
MgSO 4 + 2NaOH \u003d Mg (OH) 2 ↓ + Na 2 SO 4 ،
MgCl 2 + 2NaOH \u003d Mg (OH) 2 ↓ + 2NaCl.
نظرًا لحقيقة أنه في تفاعلات بيكربونات مع القلويات ، يتم تشكيل الصودا ، والتي تتفاعل لاحقًا مع صلابة غير كربونية ، يجب أن يرتبط مقدارها في نسبة صلابة الكربونات (LFA) وغير صلابة الكربونات (LFA):
- إذا كانت متساوية ، يمكن حذف الصودا ؛
- تحت شرط Lc\u003e Lnc ، يتم تشكيل فائض من الصودا.
- مع نسبة LCD< Жнк - недостаток соды и ее необходимо добавлять.
تتم عمليات الترسيب في صهاريج الترسيب والتصفية باستخدام طبقة الرواسب المعلقة.
خزانات الترسيب غير فعالة وللب هيدروكسيد التي تم الحصول عليها فيها رطوبة عالية من 97-99 ٪. لذلك ، فهي حاليا غير المستخدمة عمليا.
في الممارسة العملية ، يتم استخدام إصدارات مختلفة من المرشحات ذات طبقة الرواسب المعلقة. فيها ، يتم توفير المحلول المراد تنقيته من الأسفل ويمر عبر طبقة الرواسب. هذا يزيد من معامل تنقية المياه.
لا تستخدم طرق الكاشف في إعداد مياه الشرب. من بعدهم ، الماء له تفاعل قلوي بقوة. لذلك ، تستخدم الكواشف على نطاق واسع في الطاقة والصناعة كمرحلة أولى لتنقية المرشحات الميكانيكية. عند العمل معًا ، تسمح لك بتليين الماء ، وإزالة المواد الصلبة العالقة ، بما في ذلك الغرويات ، وتنقية المياه جزئيًا من المواد العضوية.
تجمد
لمكافحة صلابة المياه المستمرة ، يتم استخدام طريقة مثل الثلج المتجمد. للقيام بذلك ، تحتاج فقط إلى تجميد الماء تدريجيا. عندما يبقى حوالي 10٪ من السائل من الكمية الأولية ، من الضروري تصريف المياه غير المجمدة ، وإعادة الجليد إلى الماء. جميع الأملاح التي تشكل صلابة تبقى في المياه غير المجمدة.
جنبا إلى جنب مع التقطير ، هو في الوقت نفسه واحدة من الطرق لتحلية المياه المالحة للغاية لجودة الشرب.
طرق أخرى
تعتمد طريقة التحليل الكهربائي على ظاهرة الحركة الموجهة للأيونات المنحلقة بالكهرباء إلى الأقطاب الكهربائية المتصلة بشبكة التيار المباشر. وبالتالي ، فإن أيونات المعادن ، التي تحدد صلابة الماء ، محاصرة في الأقطاب الكهربائية ويتم فصلها عن الماء الخارجة من جهاز معالجة المياه.
تستخدم طريقة التأين المغنطيسي أيضًا ظاهرة الحركة المباشرة للأيونات ، ولكن بالفعل تحت تأثير المجال المغناطيسي. لزيادة عدد الأيونات في الماء ، يتم تشعيعه بشكل مبدئي بالإشعاع المؤين.
تتمثل المعالجة المغناطيسية للماء في تمرير المياه عبر نظام من الحقول المغناطيسية ذات الاتجاهات المعاكسة. نتيجة لذلك ، هناك انخفاض في درجة ترطيب المواد المذابة وخلطها في جزيئات أكبر تترسب.
تؤدي المعالجة بالموجات فوق الصوتية للماء أيضًا إلى تكوين جزيئات أكبر من المواد الذائبة مع تكوين الرواسب.
من المستحسن النظر في طريقة التبادل الأيوني وعمليات التناضح العكسي بالتفصيل في الجزء الثاني من المقال ، الذي سننشره في مجلتنا في العدد القادم.
